中和热 知识点题库
①2C(s)+O2(g)═2CO(g)△H=﹣221kJ/mol
②稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol
下列结论正确的是( )
(2)由盖斯定律结合下述反应方程式,回答问题:
①NH3(g)+HCl(g)═NH4Cl(s)△H=﹣176kJ/mol
②NH3(g)+H2O(l)═NH3•H2O(aq)△H=﹣35.1kJ/mol
③HCl(g)+H2O(l)═HCl(aq)△H=﹣72.3kJ/mol
④NH3•H2O(aq)+HCl(aq)═NH4Cl(aq)△H=﹣52.3kJ/mol
则NH4Cl(s)+2H2O(l)═NH4Cl(aq)其△H等于 kJ/mol.
(3)根据下列热化学方程式分析,写出C(s)燃烧热的热化学方程式
C(s)+H2O(l)═CO(g)+H2(g)△H1=+175.3kJ•mol﹣1
2CO(g)+O2(g)═2CO2(g)△H2=﹣566.0kJ•mol﹣1
2H2(g)+O2(g)═2H2O(l)△H3=﹣571.6kJ•mol﹣1 .
II.在饱和Mg(OH)2溶液中c(OH﹣)=1.0×10﹣4mol/L.,若往该溶液中加入NaOH溶液,使溶液中的c(OH﹣)变为原来的10倍,则Mg(OH)2在此溶液中的溶解度在理论上将变为原来的倍.
 O2(g)═CO(g)△H2 , 则△H2>△H1
C . 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D . 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
O2(g)═CO(g)△H2 , 则△H2>△H1
C . 已知2H2(g)+O2(g)═2H2O(g)△H=﹣483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D . 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=﹣57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol
 O2(g)═CO2(g)的△H=﹣283.0KJ/mol
C . 需要加热才能发生的反应一定是吸热反应
D . 1 mol硫燃烧生成气态三氧化硫所放出的热量是硫黄的燃烧热
O2(g)═CO2(g)的△H=﹣283.0KJ/mol
C . 需要加热才能发生的反应一定是吸热反应
D . 1 mol硫燃烧生成气态三氧化硫所放出的热量是硫黄的燃烧热
 2NH3(g) △H=-38.6kJ·mol-1
B . 甲烷的燃烧热为-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH= —890.3kJ·mol-1
C . 原电池中发生的反应达到平衡时,该电池仍有电流产生
D . 500 mL 2.0 mol·L-1的HCl(aq)和500 mL 2.0 mol·L-1的NaOH(aq)反应,产生的热量等于57.3 kJ
2NH3(g) △H=-38.6kJ·mol-1
B . 甲烷的燃烧热为-890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH= —890.3kJ·mol-1
C . 原电池中发生的反应达到平衡时,该电池仍有电流产生
D . 500 mL 2.0 mol·L-1的HCl(aq)和500 mL 2.0 mol·L-1的NaOH(aq)反应,产生的热量等于57.3 kJ
 O2(g)=CO(g) △H2可知△H1>△H2
O2(g)=CO(g) △H2可知△H1>△H2
 的NaOH溶液与
的NaOH溶液与  的盐酸反应,测得的中和热数值偏大
D . 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、温度计、玻璃棒
的盐酸反应,测得的中和热数值偏大
D . 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、温度计、玻璃棒
-
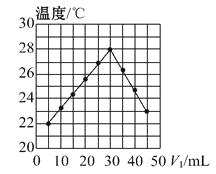
(1) Ⅰ.某实验小组对
 分解速率的影响因素做了如下探究:
分解速率的影响因素做了如下探究: 甲同学依据实验①和实验②所得数据进行处理得图1曲线,乙同学依据实验③和实验④所得数据进行处理得图2曲线。

由图1可知:该因素对过氧化氢分解速率的影响是。分析图2,可得出的结论是。
-
(2) 丙同学设计了几组实验,探究影响
 分解速率的其他因素,记录数据如表。已知表中“时间(s)”表示用20 mL
分解速率的其他因素,记录数据如表。已知表中“时间(s)”表示用20 mL  制取50 mL(常温常压下)
制取50 mL(常温常压下)  所需的时间。
所需的时间。 
15%

6%

3%

无催化剂、不加热
几乎不反应
几乎不反应
几乎不反应
无催化剂、加热
160
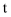
720
粉末(颗粒直径:100nm)
10
25
60
粉末(颗粒直径:1000nm)
30
70
190
推测时间t的范围为。实验结果表明,催化剂的催化效果与有关。
-
(3) Ⅱ.用如图所示装置进行中和反应反应热的测定实验,请回答下列问题:

从实验装置上看,图中尚缺少的一种仪器是。
-
(4) 取50 mL 0.5
 盐酸与50 mL 0.55
盐酸与50 mL 0.55  NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.0℃,已知中和后生成溶液的比热容
NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.0℃,已知中和后生成溶液的比热容  ,假设盐酸和NaOH溶液的密度都是1
,假设盐酸和NaOH溶液的密度都是1 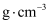 。计算该实验测得的中和热
。计算该实验测得的中和热 
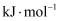 。
。
-
(5) 现将一定量的稀盐酸、稀硝酸、稀醋酸分别和1 L 1
 稀NaOH溶液恰好完全反应,其反应热分别为
稀NaOH溶液恰好完全反应,其反应热分别为  、
、  、
、  ,则
,则  、
、  、
、  的大小关系为。
的大小关系为。
 , 则甲烷燃烧的热化学方程式可表示为:
, 则甲烷燃烧的热化学方程式可表示为: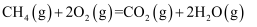
 B . 在101kPa时,2g
B . 在101kPa时,2g 完全燃烧生成液态水,放出285.8kJ热量,
完全燃烧生成液态水,放出285.8kJ热量, 燃烧的热化学方程式表示为
燃烧的热化学方程式表示为
 C . HCl和NaOH反应的中和热
C . HCl和NaOH反应的中和热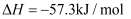 , 则
, 则 和
和 反应的中和热
反应的中和热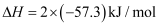 D . 500℃、30MPa下,已知热化学方程式:
D . 500℃、30MPa下,已知热化学方程式: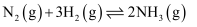
 , 将
, 将 和
和 置于密闭容器中充分反应生成
置于密闭容器中充分反应生成 , 放热38.6kJ
, 放热38.6kJ
 溶液和
溶液和 溶液反应的中和热
溶液反应的中和热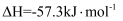 , 则
, 则 溶液和足量
溶液和足量 溶液反应的
溶液反应的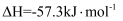 B . 常温下,
B . 常温下, 均为9的醋酸钠和氢氧化钠溶液混合后
均为9的醋酸钠和氢氧化钠溶液混合后 改变
C . 在
改变
C . 在 反应中,若生成
反应中,若生成 氯气,转移电子的数目为
氯气,转移电子的数目为 D . 为加强生态文明建设,我国大力发展核电、光电、风电、水电,电能属于一次能源
D . 为加强生态文明建设,我国大力发展核电、光电、风电、水电,电能属于一次能源



