中和热 知识点
中和热 知识点题库
①量取50mL 0.25mol/L硫酸倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.
请回答:
-
(1) NaOH溶液稍过量的原因.
-
(2) 加入NaOH溶液的正确操作是__________(填字母).A . 沿玻璃棒缓慢加入 B . 一次迅速加入 C . 分三次加入
-
(3) 使硫酸与NaOH溶液混合均匀的正确操作是.
-
(4) 设溶液的密度均为1g•cm﹣3 , 中和后溶液的比热容c=4.18J•(g•℃)﹣1 , 请根据实验数据求出中和热为 ,写出该反应的热化学方程式.
温度
实验次数
起始温度t1/℃
终止温度
t2/℃
温度差平均值
(t2﹣t1)/℃
H2SO4
NaOH
平均值
1
25.0
25.2
25.1
28.5
3.4
2
24.9
25.1
25.0
28.3
3.3
3
25.6
25.4
25.5
29.0
3.5
-
(5) 若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量(填“小于”、“等于”或“大于”)57.3kJ,原因是.
-
(1) 下列△H表示物质燃烧热的是;表示物质中和热的是.(填“△H1”、“△H2”和“△H3”等)
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
-
(2) 已知在101kPa、273K时,15g乙烷燃烧生成CO2和液态水,放出akJ的热量,下列热化学方程式正确的是 .A . C2H6(g)+
 O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B . C2H6(g)+
O2(g)=2CO2(g)+3H2O(l)△H=+2akJ/mol
B . C2H6(g)+  /2O2(g)=2CO2(g)+3H2O(g)△H=﹣2akJ/mol
C . 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=﹣4akJ/mol
D . 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=﹣4akJ/mol
/2O2(g)=2CO2(g)+3H2O(g)△H=﹣2akJ/mol
C . 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l)△H=﹣4akJ/mol
D . 2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H=﹣4akJ/mol
-
(3) 进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关(键能可以简单地理解为断开1mol化学键时所需吸收的能量),如表是部分化学键的键能数据:
化学键
P﹣P
P﹣O
O═O
P═O
键能KJ/mol
197
360
499
a
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则如表中a=.
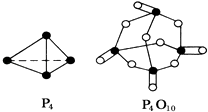
-
(4) 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为.
-
(1) Ⅰ.利用如图所示装置测定中和热
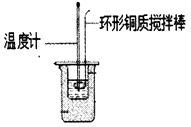
图中明显有一处错误,请指出
-
(2) (填“能”或“不能”)用Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸进行中和热测定
-
(3) Ⅱ.探究硫酸铜的量对氢气生成速率的影响。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
实验
混合溶液
A
B
C
D
E
F
4mol/L H2SO4/mL
30
V1
V2
V3
V4
V5
饱和CuSO4溶液/mL
0
0.5
2.5
5
V6
20
H2O/mL
V7
V8
V9
V10
10
0
①请完成此实验设计,其中: V8=
②当CuSO4溶液少量时,反应速率明显加快,原因
③当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
 Ba(OH)2(aq)+
Ba(OH)2(aq)+  H2SO4(aq)=
H2SO4(aq)=  BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
B . KOH(aq)+
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
B . KOH(aq)+  H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C . 2NaOH(aq)+H2SO4(aq)= Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
D . KOH(aq)+
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C . 2NaOH(aq)+H2SO4(aq)= Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
D . KOH(aq)+  H2SO4(浓)=
H2SO4(浓)=  K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是( )
 H2SO4(aq)+
H2SO4(aq)+  Ba(OH)2(aq)=
Ba(OH)2(aq)=  BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D . 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D . 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
-
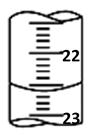
(1) Ⅰ.某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
将5.0 g烧碱样品(杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,如图是某次滴定时的滴定管中的液面,其读数为 mL。
-
(2) 由下表数据得出NaOH的百分含量是。
滴定次数
待测NaOH溶液体积(mL)
标准盐酸体积
滴定前的刻度(mL)
滴定后的刻度(mL)
第一次
10.00
0.40
20.50
第二次
10.00
4.10
24.00
-
(3) Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+。
③终点时用去20 mL 1.0×10﹣4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式。
-
(4) 滴定时,将KMnO4溶液装在(填“酸式”或“碱式”)滴定管中。
-
(5) 判断滴定终点的方法是。
-
(6) 误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果。
-
(7) 计算:血液中含钙离子的浓度为mol/L。
-
(8) Ⅲ.50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

从实验装置上看,图中缺少的一种玻璃用品是。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将(填“偏大”、“偏小”或“无影响”)。
-
(9) 已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:。
 (aq)+
(aq)+  (aq)+2
(aq)+2  (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H  O(1)
O(1)  H=
H= 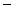 114.6 kJ/mol
B . 2KOH(aq)+ H
114.6 kJ/mol
B . 2KOH(aq)+ H  SO4(aq)= K
SO4(aq)= K  SO4(aq)+2H
SO4(aq)+2H  O(l)
O(l)  H=
H= 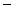 114.6kJ/mol
C . C8H18(l)+
114.6kJ/mol
C . C8H18(l)+ 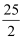 O
O  (g)=8CO
(g)=8CO  (g)+ 9H
(g)+ 9H  O
O  H=
H=  5518 kJ/mol
D . 2C8H18(g)+25O
5518 kJ/mol
D . 2C8H18(g)+25O  (g)=16CO
(g)=16CO  (g)+18H
(g)+18H  O(1)
O(1)  H=
H=  5518 kJ/mol
5518 kJ/mol
-
(1) 用0.1mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出kJ的能量。
-
(2) 如图所示装置中,仪器A的名称是,作用是;碎泡沫塑料的作用是。

-
(3) 通过实验测定的中和热的ΔH常常大于-57.3kJ/mol,其原因可能是。
H2(g)+Cl2(g)=2HCl(g) △H = -a kJ·mol-1



