中和热 知识点题库
下列叙述正确的是 ( )
A . 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B . 含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l)H = -a kJ·mol-1
C . 电解精炼铜时,同一时间内阳极溶解铜的质量可能比阴极析出铜的质量小
D . 对于2HI(g) H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
下列关于热化学反应的描述中正确的是
A . HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B . CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)==2CO(g)+O2(g) △H=+566.0kJ/mol
C . 需要加热才能发生的反应一定是吸热反应
D . 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
强酸和强碱稀溶液的中和热可表示为( )
H+(aq)+OH﹣(aq)=H2O(l),△H=﹣57.3kJ/mol
①HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l),△H=﹣akJ/mol
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l),△H=﹣bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l),△H=﹣ckJ/mol
则a,b,c三者的大小关系判断错误的是( )
A . c>114.6
B . a<57.3
C . b>57.3
D . 2a=2b=c
下列有关描述中正确的是( )
A . HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B . 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C . 需要加热才能发生的反应一定是吸热反应
D . CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
-
(1) 在101 kPa时,足量H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为,表示H2燃烧热的热化学方程式为 。
-
(2) 1.00 L 1.00 mol·L-1硫酸与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为,表示其中和热的热化学方程式为。
下列有关实验叙述正确的是( )
A . 氢氧化铁胶体制备:向沸水中逐滴加入少量饱和硫酸铁溶液,继续加热煮沸至液体变为红褐色,停止加热
B . 用容量瓶配制溶液时,定容时俯视刻度线,所配溶液浓度偏大
C . 中和热实验,在操作时应将碱液分多次倒入酸中,以防液体溅出,产生误差
D . 萃取碘水中的碘实验时,将碘水倒入分液漏斗,然后再注入乙醇,振荡、静置分层后,下层紫色液体先从下口放出,之后,上层无色液体从上口倒出
下列说法错误的是( )
A . 反应物的总能量低于生成物的总能量时,该反应为吸热反应
B . 在稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。含0.5molH2SO4的浓硫酸与含1molNaOH的稀溶液混合,放出的热量大于57.3kJ
C . 由C(石墨)= C(金刚石)△H﹥0,可知石墨比金刚石稳定
D . 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1)△H=-285.8kJ/mol
在下列各说法中,正确的是( )
A . ΔH>0表示放热反应
B . 1mol H2与0.5mol O2反应放出的热就是H2的燃烧热
C . 1mol H2SO4与1mol Ba(OH)2完全反应放出的热叫做中和热
D . 热化学方程式中的化学计量数表示物质的量,可以用分数表示
下列依据热化学方程式得出的结论正确的是()
A . 已知 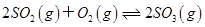 为放热反应,则SO2的能量一定高于SO3的能量
B . 已知
为放热反应,则SO2的能量一定高于SO3的能量
B . 已知 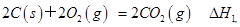 ,
, 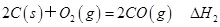 ,则ΔH1<ΔH2
C . 已知
,则ΔH1<ΔH2
C . 已知 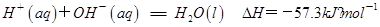 ,则任何酸碱中和反应的热效应数值均为57.3kJ
D . 已知
,则任何酸碱中和反应的热效应数值均为57.3kJ
D . 已知 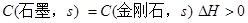 ,则金刚石比石墨稳定
,则金刚石比石墨稳定
下列说法或表示方法中正确的是( )
A . 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B . 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH= -285.8kJ/mol
C . Ba(OH)2•8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D . 已知中和热为57.3kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ
下列说法错误的是( )
A . 化学反应过程中一定伴随着能量的变化,遵循能量守恒定律
B . 氢气热值高,利用化石燃料燃烧放出的热量分解水产生氢气,是氢能开发的方向
C . 101kPa下,S(s)+O2(g)=SO2(g)的反应热可以表示S(s)的标准燃烧热
D . 稀的强酸和强碱反应只生成1molH2O(1)的反应热为中和热
下列说法正确的是( )
A . 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同
B . 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小
C . 若①2H2(g)+O2(g)=2H2O(g)△H=-akJ·mol-1 , ②2H2(g)+O2(g)=2H2O(l)△H=-bkJ·mol-1 , 则a>b
D . 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
下列有关实验说法,错误的是( )
A . 沉淀的颗粒较大且易沉降时,也可用倾析的方法将固体与溶液分离
B . 可用纸层析法分离含少量Fe3+和Cu2+的混合溶液,亲水性强的Cu2+在滤纸条的下方
C . 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、普通玻璃棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度
D . 强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗
中和热的热化学方程式:H+(aq)+OH﹣(aq)═H2O,△H=﹣57.3 kJ/mol,下列有关说法正确的是( )
A . 准确测量中和热的实验过程中,酸所提供的n(H+)应该等于碱所提供的n(OH﹣)
B . 准确测量中和热的实验过程中,酸可以选用浓硫酸
C . 中和热测定过程中,环形玻璃搅拌棒若用铜棒代替,则测量出的中和热数值偏小
D . 若CH3COOH (aq)+NaOH (aq)═CH3COONa(aq)+H2O(1)△H=﹣akJ/mol,则a>57.3
下列热化学方程式中,正确的是( )
A . 甲烷的燃烧热为890.3kJ·mol-1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B . 500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g)△H=-38.6kJ·mol-1
C . HCl和NaOH反应的中和热△H=-57.3kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D . 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
C . HCl和NaOH反应的中和热△H=-57.3kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D . 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
下列有关中和热的说法正确的是( )
A . 1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
B . 在测定中和热时,使用稀醋酸代替稀盐酸,所测中和热数值偏大
C . 在测定中和热时,用铜质搅拌棒代替环形玻璃搅拌棒,对测定结果无影响
D . 在测定中和热时,分多次将NaOH溶液加入盐酸中,所测中和热数值偏小
下列说法正确的是( )
A . HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol
B . CO(g)的燃烧热是ΔH=-283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol
C . 101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
D . 反应物所具有的总能量小于生成物所具有的总能量时,△H<0
关于化学反应与能量的说法正确的是( )
A . 书写热化学方程式时,只要在化学方程式的右边写上能量变化值即可
B .  (浓)与
(浓)与  完全中和所放出的热量等于中和热的数值
C . 同温同压下,
完全中和所放出的热量等于中和热的数值
C . 同温同压下,  在光照和点燃条件下的
在光照和点燃条件下的  相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的
相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的 
 (浓)与
(浓)与  完全中和所放出的热量等于中和热的数值
C . 同温同压下,
完全中和所放出的热量等于中和热的数值
C . 同温同压下,  在光照和点燃条件下的
在光照和点燃条件下的  相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的
相同
D . 催化剂可以同时降低正逆反应的活化能,从而降低反应的 
下列说法正确的是( )
A . 在25℃、101 kPa时,1 mol S(s)和2 mol S(s)分别充分燃烧,S(s)的燃烧热相等
B . 含1molH2SO4的稀溶液与含1molBa(OH)2的稀溶液完全中和时所放出的热量为中和热
C . 1 mol H2(g)燃烧生成1 mol H2O(g)时放出的热量为H2(g)的燃烧热
D . 中和热指的是酸与碱发生中和反应时放出的热量
下列说法或表示方法中正确的是( )
A . 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应ΔH1>ΔH2
B . 由C(石墨)→C(金刚石)ΔH=+1.9kJ/mol,可知金刚石比石墨稳定
C . 已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量。则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l)ΔH=+285.8kJ/mol
D . 在稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,若将含0.5mol硫酸的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
最近更新



