中和热 知识点题库
含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.6kJ的热量,表示该反应中和热的热化学方程式正确的是( )
A . NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) △H=+28.6kJ/mol
B . NaOH(aq)+HCL(aq) = NaCl(aq)+H2O(1) △H=-28.6kJ/mol
C . NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) △H=+57.2kJ/mol
D . NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(1) △H=-57.2kJ/mol
下列说法正确的是( )
A . HClO和NaClO都是弱电解质
B . 胶体能产生丁达尔效应,而溶液不能
C . 1mol H2SO4与1mol Ba(OH)2反应放出的热量叫做中和热
D . HCl和NaCl溶于水破坏的化学键完全相同
下列说法不正确的是( )
A . 需要加热方能发生的反应不一定是吸热反应
B . 反应是吸热还是放热取决于反应物和生成物所具有的总能量的相对大小
C . 测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度
D . 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
下列各项叙述中不正确的是( )
A . 10℃时NaCl溶解度为35.7g,则此时饱和NaCl 溶液的质量分数小于35.7%
B . 向Na2CO3溶液中加入少量NaHCO3 固体,溶液pH 减小
C . 50mL1.0mol•L﹣1盐酸与60mL 1.0 mol•L﹣1盐酸分别跟50mL 1.1mol•L﹣1NaOH溶液进行反应,中和热数值不相等
D . 一定条件下,向水中加入少量NaHSO4 , 可使水的电离程度减小
(1)已知含11.2g KOH的稀溶液与1L0.1mol•L﹣1的H2SO4稀溶液反应放出11.46KJ的热量.请写出KOH的稀溶液与的H2SO4稀溶液发生中和反应,表示中和热的热化学方程式为
(2)在相同条件下,下列两个反应的反应热分别为△H1和△H2表示:
①2H2 (g)+O2(g)=2H2O(g)△H1 ,
②2H2 (g)+O2(g)=2H2O(l)△H2 , 则△H1和△H2的关系为
已知H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,向50mL 2mol/L的NaOH溶液中加入1mol/L的某种酸恰好完全反应,测得加入酸的体积与反应放出热量的关系如下图所示(不考虑热量的散失),则该酸可能是( )

A . 醋酸(CH3COOH)
B . 盐酸
C . 草酸(HOOC﹣COOH)
D . 硫酸
下列有关化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol
B . CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol
C . 甲烷的燃烧热△H=﹣890.3kJ•mol﹣1 , 则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ•mol﹣1
D . Mg在CO2中燃烧生成MgO和C,该反应中化学能全部转化为热能
下列说法正确的是( )
A . 测定HCl和NaOH反应中和热,应测量盐酸、NaOH起始温度和反应后终止温度
B . 1molH2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热ΔH=+285.8kJ/mol
C . 1molC与O2反应生成1molCO时,放出110.5kJ热量,则C的燃烧热为110.5kJ/mol
D . 在稀溶液中:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ
某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL 0.55mol/L 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:

-
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是,烧杯间填满碎塑料泡沫的作用是。
-
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值(填“偏大”、“偏小’、“无影响”)
-
(3) 实验中改用20 mL 0.50 mol/L的盐酸跟20mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),理由是;所求中和热的数值会(填“相等”或“不相等”),理由是。若他测得Δt=3℃,则中和热ΔH为
下列热化学方程式书写正确的是( )
A . 2NO2=2NO+O2△H=-184.6kJ/mol(反应热)
B . NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=57.3kJ/mol(中和热)
C . C(s)+1/2O2(g)=CO(g)△H=-184.6kJ/mol(燃烧热)
D . S(s)+O2(g)=SO2(g)△H=-184.6kJ/mol(燃烧热)
已知稀溶液中H+(aq)+OH-(aq)=H2O(l),生成1 mol H2O(l)放出57.3 kJ热量。下列过程中放出热量为57.3 kJ的是( )
A . 1 mol H2SO4与足量的NaOH溶液反应
B . 稀盐酸与氨水反应生成1 mol H2O(l)
C . 稀盐酸与稀Ba(OH)2溶液反应生成1 mol H2O(l)
D . 稀NaOH与98%浓硫酸反应生成1 mol H2O(l)
下列关于热化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B . 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C . 需要加热才能发生的反应一定是吸热反应
D . CO(g)的燃烧热是283.0 kJ·mol-1 , 则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O( l )△H=-57.3kJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3 , 下列关系正确的是( )
A . △H1>△H2>△H3
B . △H1<△H2<△H3
C . △H1>△H2=△H3
D . △H1=△H2<△H3
按要求书写下列热化学方程式。
-
(1) 25℃、101 kPa时,1 g乙烯完全燃烧生成液态水时放出的热量是50 kJ.则表示乙烯燃烧热的热化学方程式是。
-
(2) 由氢气和氧气反应生成1mol水蒸气的过程中放热241.8kJ,写出该反应的热化学方程式 。若9g水蒸气转化成液态水时放热22kJ,则反应H2(g)+
 O2(g)=H2O(1)的△H= kJ·mol-1。
O2(g)=H2O(1)的△H= kJ·mol-1。
-
(3) 已知稀溶液中, 1 mol H2SO4与NaOH恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式: 。
-
(4) 已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g)△H=-129kJ·mol-1
写出由CH4和H2O(g)生成CH3OH和H2的热化学方程式 。
“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备。
-
(1) 用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水
已知:N2(g)+2O2(g)=N2O4(g)△H=10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ·mol-1
写出气态肼和N2O4反应的热化学方程式为 。
-
(2) 已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮,试推断由二氧化氮制取四氧化二氮的反应条件(或措施)。
-
(3) 25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3kJ的热,则CO的燃烧热为,其燃烧的热化学方程式是。
-
(4) 0.50L2.00mol/LH2SO4溶液与2.00L1.00mol/LKOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为,表示其中和热的热化学方程式为 。
-
(5) 已知拆开1 molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式是。
指出下列说法正确的是( )
A . 生物体内进行的缓慢氧化反应是放热反应。
B . 化学键形成时释放的能量越多,化学键越活泼。
C . 需要加热条件的化学反应都是吸热反应
D . 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
下列关于热化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol
B . 碳与二氧化碳的反应既是吸热反应,又是化合反应.
C . 热化学方程式中化学计量数可表示分子个数
D . 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
下列有关热化学方程式的叙述正确的是( )
A . 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2 , 则ΔH1>ΔH2
B . 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C . 在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的稀溶液混合,放出的热量等于57.3 kJ
D . 需要加热的反应说明它是吸热反应
含11.2gKOH的稀溶液与1L0.1mol•L-1H2SO4溶液反应放出11.46kJ的热量,该中和反应的热化学方程式正确的是( )
A . KOH(aq)+  H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l) △H=-11.46kJ•mol-1
B . 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46kJ•mol-1
C . 2KOH+H2SO4=K2SO4+2H2O △H=-11.46kJ•mol-1
D . KOH(aq)+
K2SO4(aq)+H2O(l) △H=-11.46kJ•mol-1
B . 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46kJ•mol-1
C . 2KOH+H2SO4=K2SO4+2H2O △H=-11.46kJ•mol-1
D . KOH(aq)+  H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l) △H=-57.3kJ•mol-1
K2SO4(aq)+H2O(l) △H=-57.3kJ•mol-1
 H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l) △H=-11.46kJ•mol-1
B . 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46kJ•mol-1
C . 2KOH+H2SO4=K2SO4+2H2O △H=-11.46kJ•mol-1
D . KOH(aq)+
K2SO4(aq)+H2O(l) △H=-11.46kJ•mol-1
B . 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46kJ•mol-1
C . 2KOH+H2SO4=K2SO4+2H2O △H=-11.46kJ•mol-1
D . KOH(aq)+  H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l) △H=-57.3kJ•mol-1
K2SO4(aq)+H2O(l) △H=-57.3kJ•mol-1
中和热是指在稀溶液中,强酸、强碱发生中和反应生成可溶性盐和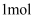 液态水时放出的热量.科学实验测定,中和热为
液态水时放出的热量.科学实验测定,中和热为 . 下列表达正确的是( )
. 下列表达正确的是( )
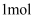 液态水时放出的热量.科学实验测定,中和热为
液态水时放出的热量.科学实验测定,中和热为 . 下列表达正确的是( )
. 下列表达正确的是( )
A . 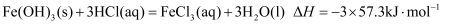 B . 在中和反应反应热的测定过程中,可让酸(或碱)稍稍过量,使碱(或酸)被完全中和
C .
B . 在中和反应反应热的测定过程中,可让酸(或碱)稍稍过量,使碱(或酸)被完全中和
C . 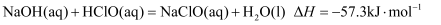 D . 在中和反应反应热的测定过程中可用温度计代替环形玻璃搅拌棒
D . 在中和反应反应热的测定过程中可用温度计代替环形玻璃搅拌棒
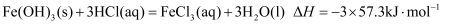 B . 在中和反应反应热的测定过程中,可让酸(或碱)稍稍过量,使碱(或酸)被完全中和
C .
B . 在中和反应反应热的测定过程中,可让酸(或碱)稍稍过量,使碱(或酸)被完全中和
C . 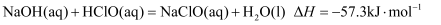 D . 在中和反应反应热的测定过程中可用温度计代替环形玻璃搅拌棒
D . 在中和反应反应热的测定过程中可用温度计代替环形玻璃搅拌棒
最近更新



