盖斯定律及其应用 知识点题库
-
(1) 已知:C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ•mol﹣1
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ•mol﹣1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=kJ•mol﹣1 .
-
(2) 利用反应CO(g)+H2(g)+O2(g)=CO2(g)+H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示.则有:

①燃料电池即电源的N极的电极反应式为;
②已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为.
CO2(g)+C(s)=2CO(g) ΔH2
2CO(g)+O2(g)=2CO2(g) ΔH3
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
Ⅰ.CH3CH2CH2CH3 (g)  CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g)  CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
-
(1) 维持体系温度T不变,总压p恒定时,体积为V1 L的正丁烷发生裂解反应,一段时间平衡后气体体积变为V2 L,此时正丁烷的转化率a(正丁烷)=;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正丁烷的转化率将(填“增大”、“不变”或“减小”),原因为。
-
(2) 一定温度下向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5 molCH4发生反应CH3CH=CH2(g) +CH4(g)
 CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。
CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。①△H3=。
②5min内该反应的反应速率v(CH4)=。
③保持温度不变,向某密闭容器中充入等物质的量的CH3CH =CH2和CH4 , 平衡后容器内CH4的体积分数为。
-
(3) 将0.1molCH2=CH2完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3 三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:

其中图中表示原氢氧化钠溶液浓度为3mol·L-1的是(选填“a”、“b”、“c”、“d”或“e” ),
-
(4) 以氢氧化钠溶液为电解质溶液,CH2=CH2 燃料电池的负极反应式为。

-
(1) 反应物和生成物均为气态的某可逆反应,在不同条件下的反应历程分别为A、B,如图所示。
①正反应的活化能为(用图中字母表示);
②当反应达平衡后,其他条件不变,升高温度,反应物的转化率将(填“增大”、“减小”、“不变”);
③B历程表明此反应采用的条件为(填标号)。
A.升高温度
B.降低温度
C.增大反应物浓度
D.使用催化剂
-
(2) 在如图的转化关系中(X代表卤素)。△H20(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为。

-
(3) 甲醇(
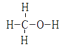 )是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
)是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3已知反应①中的相关的化学键键能数据如下:
化学键
H-H
C-O
C
 O
OH-O
C-H
E/(kJ·mol-1)
436
343
1076
465
413
①计算△H1=kJ.mol-1;
②已知△H3=+41.1 kJ.mol-1 , 则△H2 =kJ.mol-1。
-
(1) 页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJ•mol-1、-b kJ•mol-1、-c kJ•mol-1;
②H2O (l) =H2O(g); △H=+dkJ•mol-1
则△H1= (用含字母a、
B、
C、d的代数式表示)kJ•mol-1。
-
(2) 用合成气生成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g) △H2 , 在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2 , 测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2 , 在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2 , 测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示: 
t/min
0
1
3
5
n(H2)/mol
8.0
5.4
4.0
4.0
①△H2 (填“>”“<”或“ = ”)0。
②下列说法正确的是 (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 0〜3 min内用CH3OH表示的反应速率v(CH3OH)=mol • L-1·min-1。
④ 200℃时,该反应的平衡常数K =。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡(填“正向”、“逆向”或“不”)移动。
-
(3) 甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为。
 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
-
(1) 已知H2或CO可以催化还原NO以达到消除污染的目的。N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1 , 2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1 , 则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是,判断该反应自发进行的条件:(填“高温自发”或“低温自发”)。
-
(2) 当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)
 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。 
①则该反应的△H0(填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
-
(3) 某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
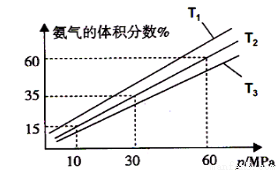
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=(用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
-
(1) SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式。
-
(2) SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为kJ·mol-1。
-
(3) 对于反应2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。 
①343K时,反应的平衡转化率α=%。平衡常数K343 K=(保留2位小数)。
②在343K下:要提高SiHCl3转化率,可采取的措施是;要缩短反应达到平衡的时间,可采取的措施有。
-
(4) 甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应I(主):CH3OH(g)+H2O(g)
 CO2(g)+3H2(g) ΔH1=+49kJ/mol
CO2(g)+3H2(g) ΔH1=+49kJ/mol反应II(副):H2(g)+CO2(g)
 CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol温度高于300℃则会同时发生反应III:CH3OH(g)
 CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3反应1能够自发进行的原因是,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是。写出一条能提高CH3OH转化率而降低CO生成率的措施。
-
(1) 已知下列热化学方程式:
①H2O(l)=H2(g)+
 O2(g) ΔH=+285.8 kJ/mol
O2(g) ΔH=+285.8 kJ/mol②H2(g)+
 O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
④C(s)+
 O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol⑤C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时(填“吸收”或“放出”)热量,△H0(填“>”或“<”),上述反应中属于吸热反应的是,C(s)的燃烧热为。
-
(2) 习.平总书记提出:绿水青山就是金山银山。我们在发展经济的同时要坚持节约资源和保护环境。
①用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1 ①
N2(g)+O2(g)=2NO(g) ΔH2=-b kJ·mol-1 ②
若1molNH3还原NO至N2 , 则该反应过程中的反应热ΔH3=kJ·mol-1(用含a、b的式子表示)。
②捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1反应Ⅱ:NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3请回答下列问题: ΔH3与ΔH1、ΔH2之间的关系是ΔH3=。
①2Li(s)+ H2(g)=2LiH(s) △H=-182 kJ/mol
②2H2(g)+O(g)=2H2O1) △H=- 572 kJ/mol
③4Li(s)+O2(g) = 2Li2O(s) △H=-1196 kJ/mol
则反应2LiH(s)+O2(g)=Li2O(s)+H2O(l)的焓变为( )
已知:CO(g)的燃烧热为283.0
kJ·mol-1;N2(g)+O2(g)  2NO(g) △H1=+180.0 kJ·mol-1。
2NO(g) △H1=+180.0 kJ·mol-1。
请回答下列问题:
-
(1) 反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H=。
N2(g)+2CO2(g) △H=。
-
(2) 用活性炭还原法可处理氮氧化物。向2 L恒容恒温密闭容器中加入足量的活性炭和2.0 mol NO,发生反应C(s)+2NO(g)
 N2(g)+CO2(g) △H<0。300℃时,测得反应进行到不同时间各物质的物质的量浓度如图所示。
N2(g)+CO2(g) △H<0。300℃时,测得反应进行到不同时间各物质的物质的量浓度如图所示。 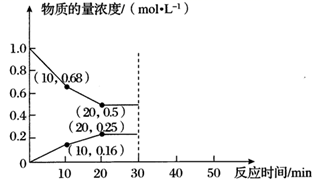
①300℃时,10min内,该反应的平均速率v(N2)=,平衡常数K=。
②保持反应条件与前30min的条件相同,若第30min时向该容器中再加入1 mol NO,则到达新平衡时,c(NO)=。
③若保持其他条件不变,将起始容器改为绝热密闭容器,则到达平衡所需的时间将(填“>”“<”或“=”)20 min。
-
(3) 以石墨为电极,稀NH4NO3为电解质溶液,电解废气中的NO生成NH4NO3的工作原理如图所示:

物质X的化学式为,电解时阴极的电极反应式为。
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
-
(1) 已知:
 (g) =
(g) =  (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:  (g)+ I2(g) =
(g)+ I2(g) =  (g)+2HI(g) ③ ΔH3=kJ·mol −1。
(g)+2HI(g) ③ ΔH3=kJ·mol −1。
-
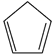
(2) 某温度下,等物质的量的碘和环戊烯(
 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为,该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为,该反应的平衡常数Kp=Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。 A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
-
(3) 环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________(填标号)。
 A . T1>T2 B . a点的反应速率小于c点的反应速率 C . a点的正反应速率大于b点的逆反应速率 D . b点时二聚体的浓度为0.45 mol·L−1
A . T1>T2 B . a点的反应速率小于c点的反应速率 C . a点的正反应速率大于b点的逆反应速率 D . b点时二聚体的浓度为0.45 mol·L−1
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。主反应:
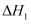
副反应:

回答下列问题:
-
(1) 已知
 、
、 和
和 的燃烧热
的燃烧热 分别为
分别为 、
、 和
和 , 该催化重整主反应的
, 该催化重整主反应的
 。有利于提高
。有利于提高 平衡转化率的条件是(填标号)。
平衡转化率的条件是(填标号)。A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
-
(2) 在刚性密闭容器中,进料比
 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。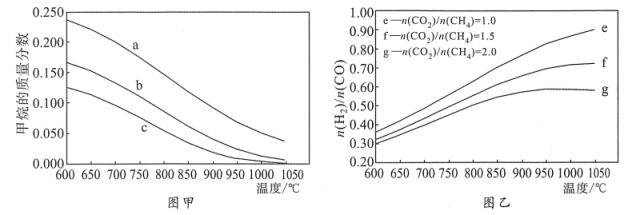
①甲烷的质量分数随温度变化的关系如图甲所示,曲线
 对应的
对应的 ;
;②反应体系中,
 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加, 的值(填“增大”、“不变”或“减小”),其原因是。
的值(填“增大”、“不变”或“减小”),其原因是。 -
(3) 在
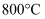 、
、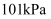 时,按投料比
时,按投料比 加入刚性密闭容器中,达平衡时甲烷的转化率为
加入刚性密闭容器中,达平衡时甲烷的转化率为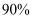 , 二氧化碳的转化率为
, 二氧化碳的转化率为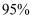 , 则副反应的压强平衡常数
, 则副反应的压强平衡常数 (计算结果保留3位有效数字)。
(计算结果保留3位有效数字)。
-
(4) 我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气
 和
和 , 同时获得甘油醛。则催化电极
, 同时获得甘油醛。则催化电极 为极,催化电极
为极,催化电极 产生
产生 的电极反应式为。
的电极反应式为。
-
(1) 已知①NO2(g)+CO(g)⇌CO2(g)+NO(g)△H1=-234kJ·mol-1
②N2(g)+O2(g)⇌2NO(g)△H2=+179.5kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)△H3=-112.3kJ·mol-1
NO2与CO反应生成无污染气体的热化学方程式为。
-
(2) 氨气可将氮氧化物转化为无毒气体。450℃时,在2L恒容密闭容器中充入1molNO、1molNO2和2molNH3 , 起始时体系压强为pMPa,发生反应:NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g),5min时反应达到平衡,此时测得N2的物质的量分数为
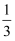 。
。①0~5min内,v(NH3)=mol·L-1·min-1 , NO的平衡转化率=%。
②450℃时,该反应的压强平衡常数Kp=(填含p的代数式,Kp为以分压表示的平衡常数,分压=总压×气体组分物质的量分数)MPa。
-
(3) 工业上,常温下将含NOx的尾气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中进行无害化处理,原理如图所示。

该吸收过程中,Ce3+/Ce4+的作用是,其中反应II的离子方程式为。
-
(1) H2S可以分解制取硫黄和氢气。已知下列热化学方程式:
SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH=-151 kJ·mol-1
2HI(aq)=H2(g)+I2(s) ΔH=+110 kJ·mol-1
H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH=+61 kJ·mol-1
则H2S分解的热化学H2S(g)=H2(g)+S(s)ΔH=kJ·mol-1。
-
(2) H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的密闭容器中,保持体积不变,反应平衡后H2O(g)的物质的量分数为0.02。在620 K重复实验,平衡后H2O(g)的物质的量分数为0.03。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的密闭容器中,保持体积不变,反应平衡后H2O(g)的物质的量分数为0.02。在620 K重复实验,平衡后H2O(g)的物质的量分数为0.03。 ①下列情况能说明该反应已到达平衡的是(填字母)。
A.容器的压强保持不变
B.容器内气体密度保持不变
C.v正(H2S)=v逆(COS)
D.H2S和CO2的物质的量之比保持不变
②平衡时只改变下列条件,既可以提高反应速率又可以提高H2S(g)转化率的是(填字母)。
A.升高容器的温度
B.保持容器体积一定,充入He,使体系总压强增大
C.缩小容器的体积,使体系总压强增大
D.分离出部分COS(g)
-
(3) 已知Ka1(H2S)=1.3×10-7 , Ka2(H2S)=7×10-15。pH=11时,含H2S、HS-和S2-的溶液中,
 =。
=。
-
(4) 一种CO2、H2S的协同转化装置可实现对天然气中CO2和H2S的高效去除。工作原理如图所示,其中电极分别为石墨烯包裹的ZnO和石墨烯,石墨烯电极发生的反应为:EDTA—Fe2+-e-=EDTA—Fe3+。

①H2S所发生反应的离子方程式为。
②阴极的电极反应式为。
-
(5) 在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图所示),该过程中部分物质的物质的量浓度随时间的变化关系如图所示:
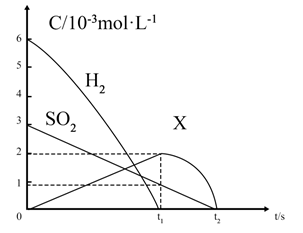
依据如图描述H2还原SO2生成S的过程:。
-
(1) 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=−534 kJ∙mol−1
H2O2(l)=H2O(l)+
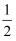 O2(g) ΔH=−98 kJ∙mol−1
O2(g) ΔH=−98 kJ∙mol−1H2O(l)=H2O(g) ΔH=44 kJ∙mol−1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式:。
-
(2) 反应的自发性由焓变和熵变两个因素决定。N2(g)+O2(g)=2NO(g),已知N≡N的键能为946 kJ∙mol−1 , O=O键的键能为498 kJ∙mol−1 , N≡O的键能为630 kJ∙mol−1;该反应的ΔH=,其反应自发的原因是。
-
(3) 电动汽车的电源常以乙醇(CH3CH2OH)为燃料的固体燃料电池,以熔融的氧化物为电解质,其高温下能传导O2− , 写出负极的电极反应式。
-
(4) 以纯铜作阴极,以石墨作阳极,电解某浓度的硫酸铜溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入16.0gCuO固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体体积为(标准状况)L。
 和
和 转化为CO和
转化为CO和 , 其主要反应如下为
, 其主要反应如下为 , 该反应历程及能量变化如图1,在发生上述反应的同时,还存在以下反应:
, 该反应历程及能量变化如图1,在发生上述反应的同时,还存在以下反应:积碳反应:

消碳反应:
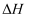
积碳会影响催化剂的的活性。反应相同时间,测得积碳量与反应温度的关系如图2。

下列说法正确的是( )
 B . 增大
B . 增大 与
与 的物质的量之比有助于减少积碳
C . 温度高于600℃,积碳反应的速率减慢,积碳量减少
D .
的物质的量之比有助于减少积碳
C . 温度高于600℃,积碳反应的速率减慢,积碳量减少
D .  和
和 反应的快慢由反应物→过渡态Ⅰ的速率决定
反应的快慢由反应物→过渡态Ⅰ的速率决定
-
(1) 在催化剂
 作用下,
作用下, 和
和 重整生成
重整生成 可能的部分反应机理如图所示,其中
可能的部分反应机理如图所示,其中 表示
表示 )。
)。
 表示原子间存在化学键,表示原子间有吸附作用
表示原子间存在化学键,表示原子间有吸附作用①反应开始时
 在催化剂表面解离为
在催化剂表面解离为 和
和 , 该过程首先是
, 该过程首先是 中的氢原子与催化剂载体上的
中的氢原子与催化剂载体上的 形成较为强烈的相互作用。请具体描述
形成较为强烈的相互作用。请具体描述 中的哪一种氢原子与
中的哪一种氢原子与 形成较为强烈的相互作用,并说明判断的理由。
形成较为强烈的相互作用,并说明判断的理由。②X的结构简式为。
-
(2)
 与
与 催化重整制氢气的主反应为
催化重整制氢气的主反应为反应Ⅰ


同时还发生副反应:
反应Ⅱ
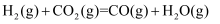

温度在300℃以上,
 也可以直接分解
也可以直接分解反应Ⅲ


①

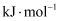
②向该体系中加入适量多孔
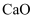 , 会提高
, 会提高 的产率,其原因是。
的产率,其原因是。 -
(3)
 与
与 催化重整制氢气的体系中,平衡时甲醇的转化率、
催化重整制氢气的体系中,平衡时甲醇的转化率、 物质的量分数与反应温度(T)以及初始加入的水醇比(S/M)的关系如图所示。例如:曲线M表示甲醇的平衡转化率均为80%时,所对应的反应温度以及初始加入的水醇比(S/M)。①其他条件相同,当温度低于300℃时,随着温度升高,平衡体系中
物质的量分数与反应温度(T)以及初始加入的水醇比(S/M)的关系如图所示。例如:曲线M表示甲醇的平衡转化率均为80%时,所对应的反应温度以及初始加入的水醇比(S/M)。①其他条件相同,当温度低于300℃时,随着温度升高,平衡体系中 的物质的量分数增大,其可能原因是。
的物质的量分数增大,其可能原因是。②氢能源汽车对氢气中的
 有严格的要求,
有严格的要求, 物质的量分数必须小于0.5%。根据如图所示,催化重整制氢气用于汽车时,适宜控制的水醇比和温度为。
物质的量分数必须小于0.5%。根据如图所示,催化重整制氢气用于汽车时,适宜控制的水醇比和温度为。
-
(1) 甲烷水蒸气重整制氢:


已知:a.

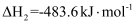 ;
;b.

 。
。①
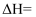
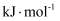 , 为了得到更多的
, 为了得到更多的 , 一般采用的反应条件是(填“高温”、“低温”或“常温”)。
, 一般采用的反应条件是(填“高温”、“低温”或“常温”)。②工业上甲烷水蒸气重整制氢的过程中,经常加入
 吸附剂
吸附剂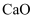 强化[
强化[
 ],相比于甲烷水蒸气重整,吸附强化甲烷水蒸气重整的优点有、。
],相比于甲烷水蒸气重整,吸附强化甲烷水蒸气重整的优点有、。 -
(2) 甲醇水蒸气重整制氢:甲醇和水蒸气重整时,未使用催化剂和使用催化剂两种反应进程中能量的变化曲线a和b如图所示。

①b过程第Ⅰ步反应和第Ⅱ步反应分别为(填“放热反应”或“吸热反应”,下同)、,第Ⅰ步反应与第Ⅱ步反应的
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) 。
。②甲醇和水蒸气重整时发生反应的热化学方程式为。
-
(1) 25℃、
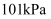 时,
时, 氨气完全燃烧放出
氨气完全燃烧放出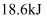 的热量,则
的热量,则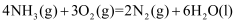
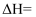
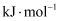 。
。
-
(2)
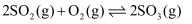 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
已知:
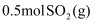 被氧化为
被氧化为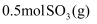 的
的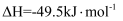 。则:
。则:①E的大小对该反应的反应热(填“有”或“无”)影响;该反应通常用
 作催化剂,加
作催化剂,加 会使图中B点(填“升高”或“降低”)。
会使图中B点(填“升高”或“降低”)。②
 氧化为
氧化为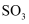 的热化学方程式为。
的热化学方程式为。 -
(3) 已知拆开
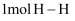 键、
键、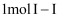 、
、 键分别需要吸收的能量为
键分别需要吸收的能量为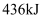 、
、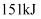 、
、 。则由氢气和碘反应生成
。则由氢气和碘反应生成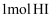 需要(填“放出”或“吸收”)
需要(填“放出”或“吸收”)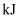 的热量。
的热量。
-
(4) 发射卫星时可用肼(
 )为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①

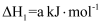
②

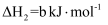
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:。



