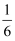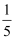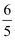氧化还原反应方程式的配平 知识点题库
编号 | a的取值范围 | 产物的化学式(或离子符号) |
① | a≤ | I2Br﹣ |
② |
| I2Br﹣Br2 |
③ |
| I2 IO3﹣ Br2 |
④ | a≥ | IO3﹣ Br2 |
-
(1) 将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
+Na2SO3+→+++H2O
-
(2) 反应物中发生氧化反应的物质是(填化学式).
-
(3) 反应中1mol氧化剂得到mol电子.
-
(1) 配平下列化学方程式:并用单线桥标出电子转移的方向和数目.
Fe3O4+CO=Fe+CO2
-
(2) 检验SO42﹣所需要用的试剂和.
-
(3) 三硅酸镁(Mg2Si3O8•11H2O)用氧化物表示.
-
(4) 0.3mol NH3 分子中所含质子数与个H2O分子中所含质子数相等.

-
(1) 取磁性氧化铁按图所示装置进行铝热反应,引发铝热反应的实验操作是。取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变为血红色。出现这种现象,一方面可能因为“铁块”中混有没反应的磁性氧化铁,另一方面可能因为。
-
(2) 请写出此铝热反应的化学方程式:,1 mol Al参与反应,转移的电子数为。
-
(3) 设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是,反应的离子方程式为。
-
(4) 除了磁性氧化铁可做铝热反应实验,下列试剂也可以发生铝热反应的是________(填字母,双选)。A . CuO B . Na2O2 C . MnO2 D . MgO

-
(1) 实验室制取乙炔时,分液漏斗中的液体a通常是。
-
(2) CuSO4溶液的作用是。
-
(3) 配平乙炔与酸性KMnO4溶液反应的化学方程式(请在方框中填计量系数):
□C2H2+□KMnO4+□H2SO4—□K2SO4+□MnSO4+□CO2↑+□H2O
-
(4) 若该小组实验原理及所有操作均符合题意,则下列各因素对所测乙炔的相对分子质量没有影响的是(填选项)____________。A . 装置A中产生的气体直接通入酸性KMnO4溶液 B . 乙炔通过酸性KMnO4溶液的速率过快,少量乙炔未被氧化而逸出 C . 将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
-
(5) 另一课外小组认为,该课外小组的实验装置及实验操作存在不足,请用简明文字说明,应采取何种措施或改进?答:。
-
(1) 工业采用高温分解H2S制取氢气,2H2S(g)
 2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。 
①反应2H2S(g)
 2H2(g) + S2(g)的ΔH(填“>”“<”或“=”)0。
2H2(g) + S2(g)的ΔH(填“>”“<”或“=”)0。②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是。
-
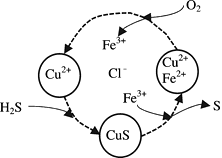
(2) 将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
①在图示的转化中,化合价不变的元素是。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有。
-
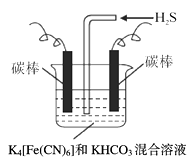
(3) 工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为。
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为。
③通入H2S 时发生如下反应,补全离子方程式:
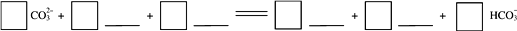
 和硝酸钾
和硝酸钾  。汽车发生猛烈撞击时,
。汽车发生猛烈撞击时, 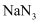 会迅速分解产生
会迅速分解产生  和Na,Na单质可与
和Na,Na单质可与  继续反应。完成下列填空:
继续反应。完成下列填空:
-
(1) 原子最外层电子的电子排布式为,氮气的电子式为。
-
(2) 请将
 、
、  、
、  按照离子半径由大到小的顺序排列
按照离子半径由大到小的顺序排列 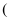 填离子符号
填离子符号 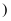 。
。
-
(3)
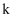 的金属性强于Na,用一个事实说明。
的金属性强于Na,用一个事实说明。
-
(4) 配平Na与
 反应的化学方程式,并标出电子转移的方向与数目:
反应的化学方程式,并标出电子转移的方向与数目: 
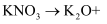

 ,若标准状况下生成
,若标准状况下生成  氮气,转移的电子数目为
氮气,转移的电子数目为  。
。 -
(5) 请解释
 晶体比
晶体比  晶体熔点低的原因。
晶体熔点低的原因。
-
(1) 配平下述化学反应方程式(请将配平的计量数依次填入上式)
其反应式为:C+K2Cr2O7+H2SO4═CO2↑+Cr2(SO4)3+K2SO4+H2O
-
(2) H2SO4在上述反应中表现出来的性质是 (填选项编号)。A . 酸性 B . 氧化性 C . 吸水性 D . 脱水性
-
(3) 上述反应中若产生0.2mol CO2 , 则转移电子的物质的量是mol。
-
(4) 上述反应中氧化剂与还原剂的物质的量比为:。
-
(1) 将上述化学方程式配平并改写为离子方程式。
-
(2) 浓盐酸在反应中显示出来的性质是。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
-
(3) 若产生0.5 mol Cl2 , 则被氧化的HClmol,转移的电子的数目约为。
-
(4) 一定条件下,KMnO4还可以氧化其他还原性物质。
MnO4-+C2O42-+=Mn2++CO2↑+完成上述离子方程式,此反应中,发生氧化反应的物质是;若转移1 mol电子,生成标准状况下CO2L。
-
(1) I、KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:□KClO3+□HCl(浓)→□KCl+□ClO2↑+□Cl2↑+□H2O+□_
请配平该化学方程式。
-
(2) 浓盐酸在反应中显示出来的性质是(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
-
(3) Ⅱ、已知反应:2H2CrO4+3H2O2=2Cr(OH)3↑+2H2O该反应中H2O2只发生如下变化过程H2O2→H2O
①该反应中的还原剂是。
②该反应中被还原的元素是,还原产物是。
③若产生的气体在标准状况下体积为3.36L,则反应中转移了mol电子
-
(1) 亚硝酰氯(C—N=O)气体是有机合成中的重要试剂,它可由Cl2和NO在通常条件下反应制得,该反应的热化学方程式为。
相关化学键的键能如下表所示:
化学键
Cl—Cl
N≡O(NO气体)
Cl—N
N=O
键能/(kJ·mol-1)
243
630
200
607
-
(2) 为研究汽车尾气转化为无毒无害的物质的有关反应,在某恒容密闭容器中充入4molCO和4 mol NO,发生反应2CO+2NO
 2CO2+N2 , 平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示:
2CO2+N2 , 平衡时CO的体积分数与温度(T1<T2)压强的关系如图所示: 
①该可逆反应达到平衡后,为在提高反应速率的同时提高NO的转化率,可采取的措施有(填标号)。
a.按体积比1:1再充入CO和NO b.改用高效催化剂
c.升高温度 d.增加CO的浓度
②由图可知,压强为20MPa、温度为T2下的平衡常数Kp=MPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。保留4位小数)。
③若在B点对反应容器降低温度至T1的同时缩小体积至体系压强增大,达到新的平衡状态时,可能是图中A~F点中的点(填标号)。
-
(3) 有人设想采用下列方法减少SO2、NO2对环境的污染:用CH4还原SO2 , 从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NO2。这种含硫化合物和NO2反应的化学方程式为。
-
(4) 用NaOH溶液吸收SO2也是减少大气污染的一种有效方法。25℃时,将一定量的SO2通入到NaOH溶液中,两者完全反应,若溶液中
 ,则该混合溶液的pH=(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2 , K a2=1.0×10-7)。
,则该混合溶液的pH=(25℃时,H2SO3的电离平衡常数Ka1=1.0×10-2 , K a2=1.0×10-7)。
-
(5) 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:

①电极b上发生的是反应(填“氧化”或“还原”)。
②电极a的电极反应为。

 2H2O+O2↑
D . 总反应为:2H2O
2H2O+O2↑
D . 总反应为:2H2O
 2H2↑+O2↑
2H2↑+O2↑
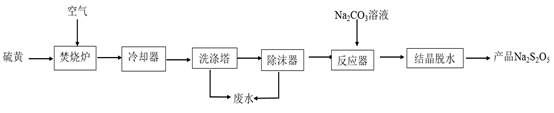
已知:NaHSO3的过饱和溶液经结晶脱水可生成Na2S2O5。
回答下列问题:
-
(1) 为便于焚烧,可对硫黄采取的措施是。
-
(2) 废水中含有硫单质,其中一种分子组成为S8 , 可与KOH溶液发生如下反应:3S8+48KOH
 16K2S+8K2SO3+24H2O,该反应中氧化剂与还原剂的物质的量之比为。
16K2S+8K2SO3+24H2O,该反应中氧化剂与还原剂的物质的量之比为。
-
(3) 反应器中发生反应的离子方程式为。
-
(4) Na2S2O5是强还原剂,很容易被O2氧化,同时放出一种有刺激性气味的气体,该反应的化学方程式为。
-
(5) Na2S2O5生产过程中会产生SO2 , SO2在空气中的含量超过0.02 mg·L-1就会危害人类健康。可用如下装置测定空气中SO2的含量。

①取5 mL 5×10-4 mol·L-1的碘溶液E入试管中,再加入2~3滴淀粉溶液,在测定地点慢慢抽气,每次抽气100 mL,直到试管中的溶液 (填写现象)。
②记录抽气次数n。n≥,说明气体符合安全标准(假设气体均处于标准状况)。
③抽气时应慢慢抽拉活塞,原因是。
①将沉淀全部放入锥形瓶中,加入足量的10%H2SO4和适量的蒸馏水,使沉淀完全溶解,溶液呈酸性,加热至75℃,趁热用0.0500mol·L-1KMnO4溶液进行滴定,记录所用KMnO4溶液的体积。
②过滤并洗涤沉淀。
③准确称取氯化钙样品0.2400g,放入烧杯中,加入适量6mol·L-1的盐酸和适量蒸馏水使样品完全溶解,再滴加35.00mL0.2500mol·L-1(NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀。经检验,Ca2+已沉淀完全。
④再重复以上操作2次并进行数据处理。
完成下列各题:
-
(1) 上面的实验步骤合理的顺序是(填序号)。
-
(2) 写出步骤①中加入KMnO4溶液后发生反应的离子方程式。
-
(3) 滴定终点判断的依据是。
-
(4) 某次实验滴定结束时滴定管内的液面见图,则此时液面读数为mL。

-
(5) 实验最终测得氯化钙样品中钙元素的质量分数38.00%(样品中不含其它含有钙元素的杂质),下列说法能合理解释该实验结果的是___。A . 酸性高锰酸钾溶液已部分变质 B . 滴定过程中,用蒸馏水冲洗锥形瓶内壁上的KMnO4溶液 C . 滴定时有部分高锰酸钾溶液滴在了实验台上 D . 酸式滴定管用蒸馏水洗过后又用所要盛装的溶液润洗
-
(1) 已知反应:
 。
。 配平该化学反应方程式。
-
(2) 如果反应中转移
 电子,则生成的
电子,则生成的  在标准状况下的体积为L。
在标准状况下的体积为L。
-
(1) 酸浸:用硫酸溶液浸取烧渣中的铁元素。若其他条件不变,下列措施中能提高单位时间内铁元素浸出率的有____(填序号)。A . 适当升高温度 B . 适当加快搅拌速率 C . 适当减小硫酸浓度
-
(2) 沉铁:取10mL“酸浸”后的滤液并加入9gNH4HCO3 , 改变氨水用量,测得铁的沉淀率随氨水用量的变化如图。
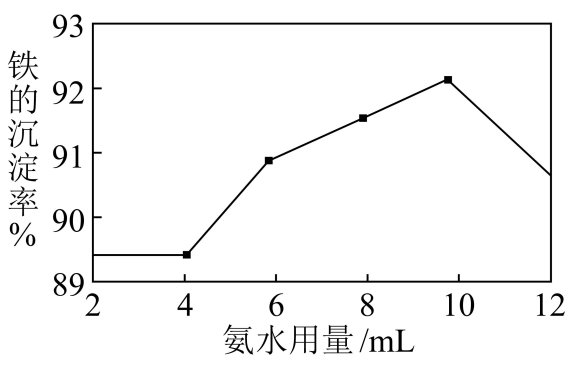
①为提高铁的沉淀率,应控制氨水用量为。②氨水用量小于4mL时,铁的沉淀率几乎无变化,其原因可能为。
-
(3) 过滤:“沉铁”后过滤,滤渣中含有FeOOH和FeCO3 , 滤液中浓度最大的阳离子是(填化学式)。
-
(4) 焙烧:FeOOH和FeCO3高温焙烧后均可得到铁红,写出FeCO3高温焙烧的化学方程式。
 溶液能被
溶液能被 溶液还原成
溶液还原成 而使溶液褪色。欲使20.00mL
而使溶液褪色。欲使20.00mL 酸性
酸性 溶液恰好褪色,需消耗25.00mL
溶液恰好褪色,需消耗25.00mL 溶液,则该
溶液,则该 溶液的物质的量浓度(单位:
溶液的物质的量浓度(单位: )为( )
)为( )
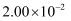 B .
B . 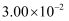 C .
C . 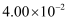 D .
D . 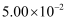

请回答下列问题:
-
(1) 滤渣1的主要成分是(填化学式);“酸浸”中硫酸溶液质量分数不宜高于49%,主要原因是。
-
(2) “一系列操作”是蒸发浓缩降温结晶、过滤、洗涤、低温干燥,采用“低温干燥”的原因是。
-
(3) “除铁”的离子方程式为。
-
(4) 已知:常温下,Ksp(CaF2)=1.5×10-10。在“除钙”中,溶液中c(F-)=0.01mol·L-1'时,c(Ca2+)=mol·L-1。
-
(5) 测定NiSO4·7H2O产品纯度:取wgNiSO4·7H2O产品于溶水配制成250mL溶液,量取配制的溶液25.00mL于维形瓶中,用cmol·L-1EDTA(用Na4Y表示)溶液滴定:Ni2++Y4-=NiY2- , 固定至终点时,消耗滴定液VmL。假设杂质不与EDTA反应,该产品的纯度为(用含c、w、V的代数式表示)。
-
(1) 高铁酸钾的制备,装置如图1所示。
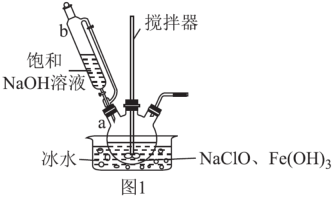
步骤一:将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称是,其侧管的作用为。
②a中制备Na2FeO4反应的离子方程式为。
③K2FeO4悬浊液经过滤、洗涤,可得粗产品。粗产品中的可溶性杂质可通过方法进一步提纯。
-
(2) K2FeO4遇水转化为Fe(OH)3 , 则其能用于净水的原理为:。
-
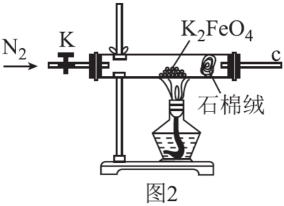
(3) 用图2所示装置探究K2FeO4受热分解的产物。设计实验方案证明完全分解后的固体产物中不含Fe(II):取完全分解后的少量固体,溶于稀硫酸,。
-
(4) 实验室可用间接碘量法测定含少量KCl杂质的K2FeO4样品的纯度:称取0.9000gK2FeO4样品溶于碱性KI溶液中,调节pH使混合液充分反应。用1.000mol·L-1的Na2S2O3标准溶液进行滴定,消耗Na2S2O3标准溶液15.00mL。请计算K2FeO4样品的纯度:。
已知:
 +4I-+8H+=Fe2++2I2+4H2O;I2+2
+4I-+8H+=Fe2++2I2+4H2O;I2+2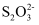 =
=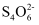 +2I-。
+2I-。