物质的量浓度 知识点题库
下列溶液中,溶质的物质的量浓度为1mol/L的是( )
A . 将40 g NaOH溶于1 L水所得的溶液
B . 将80 g SO3溶于水并配成1 L的溶液
C . 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D . 含K+为2 mol的K2SO4溶液
与50mL 0.1mol•L﹣1Na2CO3溶液中Na+的物质的量浓度相同的溶液是( )
A . 50 mL 0.2 mol•L﹣1的NaCl溶液
B . 100 mL 0.1 mol•L﹣1的NaCl溶液
C . 25 mL 0.2 mol•L﹣1的Na2SO4溶液
D . 10 mL 0.5 mol•L﹣1的Na2CO3溶液
某溶液中(假定不考虑水解因素)仅含有K+、Mg2+、SO42﹣、NO3﹣四种离子,其中K+与Mg2+的个数之比为4:5,则NO3﹣与SO42﹣的物质的量浓度之比一定不是( )
A . 8:3
B . 3:2
C . 1:3
D . 2:3
下图为实验室某盐酸试剂瓶的标签上的有关数据,试回答下列问题:

-
(1) 计算该盐酸中HCl的物质的量浓度;
-
(2) 实验室需要1.19mol/L盐酸20mL,计算所需上述盐酸的体积.
有五瓶溶液分别是:①10mL 0.6mol/L NaOH溶液;②20mL 0.5mol/L H2SO4溶液;③30mL 0.4mol/L HCl溶液;④40mL 0.3mol/L CH3COOH溶液;⑤50mL 0.2mol/L蔗糖溶液.以上各瓶溶液所含离子、分子总数的大小顺序是( )
A . ①>②>③>④>⑤
B . ②>①>③>④>⑤
C . ②>③>④>①>⑤
D . ⑤>④>③>②>①
按要求填空:
-
(1) 将质量比为7:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为;氮原子和氧原子的个数之比为;22克该混合气体在标准状况下的体积为.
-
(2) 在氯化镁和硫酸镁的混合液中,若Mg2+与Cl﹣的物质的量浓度之比为4:3时,则Mg2+与SO物质的量浓度之比为
-
(3) 将8g铁片放入100mL硫酸铜溶液中,溶液中的Cu2+全部被还原时,“铁片”变为8.4g,则原c(CuSO4)为 mol/L.
-
(4) 使4.48L CO2气体迅速通过Na2O2固体后得到3.36L(标准状况下)气体,这3.36L气体的质量是 g.
配制0.1摩/升的1000毫升硝酸溶液,需量取1摩/升硝酸100毫升,加水定容时,仰视容量瓶刻度线使凹液面最低处与刻度线有唯一交点时停止加水,并摇匀,此时配得的硝酸溶液的摩尔浓度( )
A . >0.1摩/升
B . <0.1摩/升
C . =0.125摩/升
D . 无法确定
200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为 mol/L.
向H2SO4、CuCl2混合溶液中投入足量的铁粉,经充分反应后,过滤、洗涤、干燥、称重,知所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42﹣)与c(Cl﹣)之比( )
A . 1:2
B . 1:7
C . 7:1
D . 1:14
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
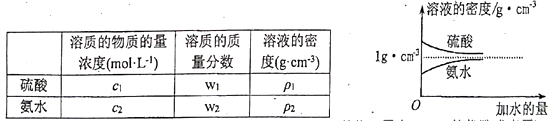
-
(1) 表中硫酸的质量分数W1为(不写单位,用含c1、p1的代数式表示)。
-
(2) 物质的量浓度为c1mol· L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为 mol· L-1 , 质量分数w1/2(填“大于”、“小于”或“等于”,下同)。
-
(3) 质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度
 。
。
10 L 1 mol/L Al2(SO4)3溶液中含有SO42-的物质的量浓度是( )
A . 1 mol/L
B . 2 mol/L
C . 3 mol/L
D . 20 mol/L
标准状况下的28LNH3溶于125mL水中,若所得氨水的密度近似为1g•cm-3 , 则下列说法正确的是( )
A . 此氨水中NH3的物质的量浓度近似为0.224mol•L-1
B . 此氨水中NH3的物质的量浓度近似为10mol•L-1
C . 此氨水中NH3的物质的量浓度近似为8.55mol•L-1
D . 此氨水中NH3的质量分数为0.17
500mL含有MgCl2 、NaCl、Na2SO4三种物质的混合溶液,已知其中含有Cl-为1.8mol,Na+ 为2mol,Mg2+ 为0.5mol,则SO42- 的物质的量浓度为( )
A . 0.6mo1/L
B . 0.7mo1/L
C . 1.0mo1/L
D . 1.2mo1/L
-
(1) Ⅰ.根据下列各题中所给出的数据,可分别求出其溶液的“溶质质量分数”或溶液的“物质的量浓度”,试求解。
已知某氢氧化钠溶液V L中含有N个氢氧根离子,可求出此溶液的物质的量浓度是。
-
(2) 已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a , 则可求出此溶液的溶质的质量分数为。
-
(3) Ⅱ.常温下,10.0 mL 1.0 mol·L-1的H2SO4(aq),加水稀释到500 mL,所得H2SO4(aq)的浓度为mol·L-1;蒸发浓缩,使溶液的体积为2.40 mL,所得H2SO4(aq)的浓度为mol·L-1。
-
(4) Ⅲ.已知标准状况下1体积水能溶解500体积的氯化氢,得到密度为1.19g/mL的盐酸,则可求出标准状况下氯化氢饱和溶液中溶质的质量分数为,该盐酸的浓度为(结果均保留一位小数)。
将6.5
g锌放入足量的稀硫酸中充分反应,得到80 mL密度为1.25 g/mL的溶液。试计算回答:
①所得溶液中硫酸锌的物质的量浓度为,质量分数为。
②生成的气体在标准状况下的体积为。
将溶质的质量分数为14%的KOH溶液加热蒸发掉100 g水后,得到溶质的质量分数为28%的溶液80 mL,此时溶液的物质的量浓度为( )
A . 5 mol·L-1
B . 6.25 mol·L-1
C . 7 mol·L-1
D . 6.75 mol·L-1
-
(1) 现有8种物质:①
 ②
② ③浓硫酸④铝⑤
③浓硫酸④铝⑤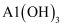 胶体 ⑥蔗糖溶液⑦
胶体 ⑥蔗糖溶液⑦ ⑧
⑧ 上述物质中属于电解质的有(选填序号);写出②的溶液与⑤反应的离子方程式
上述物质中属于电解质的有(选填序号);写出②的溶液与⑤反应的离子方程式
-
(2) 饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,研究人员提出,在碱性条件下可以用铝粉处理
的浓度,研究人员提出,在碱性条件下可以用铝粉处理 , 发生反应的化学方程式为:
, 发生反应的化学方程式为:
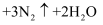 , 该反应中,还原剂为,若反应过程中转移
, 该反应中,还原剂为,若反应过程中转移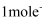 , 则生成标准状况下
, 则生成标准状况下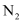 的体积为
的体积为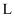 。
。
-
(3) 在含有一定量
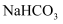 和
和 溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生
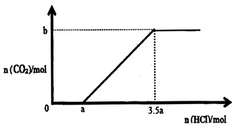
溶质的溶液中,逐滴滴入一定浓度的稀盐酸,产生 的物质的量与滴入盐酸的量的关系如图,回答下列问题:
的物质的量与滴入盐酸的量的关系如图,回答下列问题:
①
 点发生反应的离子方程式为
点发生反应的离子方程式为②
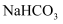 与
与 物质的量之比为
物质的量之比为③
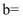 (用含
(用含 的代数式表示)
的代数式表示) -
(4) 现有密度为
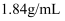 , 浓度为
, 浓度为 的浓硫酸,则该溶液中溶质的质量分数为
的浓硫酸,则该溶液中溶质的质量分数为
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 常温常压下,1 mol 与足量的
与足量的 或
或 反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L
反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L  中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的
中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的 溶液中,含有
溶液中,含有 的个数为NA
的个数为NA
 与足量的
与足量的 或
或 反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L
反应,转移的电子数目都为2NA
B . 常温下,27 g Al与足量的氢氧化钠溶液反应,转移的电子数目为3NA
C . 标准状况下,22.4 L  中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的
中含有的分子数目为NA
D . 物质的量浓度为0.5mol/L的 溶液中,含有
溶液中,含有 的个数为NA
的个数为NA
在KCl、 、
、 三种盐配成的混合溶液中,各离子的浓度如下表,则a为( )
三种盐配成的混合溶液中,各离子的浓度如下表,则a为( )
 、
、 三种盐配成的混合溶液中,各离子的浓度如下表,则a为( )
三种盐配成的混合溶液中,各离子的浓度如下表,则a为( ) |
离子 |
|
|
|
|
|
浓度(mol/L) |
0.05 |
0.25 |
0.20 |
a |
A . 0.10
B . 0.15
C . 0.25
D . 0.30
取露置于空气中的某NaOH溶液10mL,向其中逐滴加入 盐酸至过量,产生
盐酸至过量,产生 的体积(标准状况)与加入稀盐酸体积的关系如图所示(不考虑
的体积(标准状况)与加入稀盐酸体积的关系如图所示(不考虑 在水中的溶解)。则下列说法正确的是( )
在水中的溶解)。则下列说法正确的是( )
 盐酸至过量,产生
盐酸至过量,产生 的体积(标准状况)与加入稀盐酸体积的关系如图所示(不考虑
的体积(标准状况)与加入稀盐酸体积的关系如图所示(不考虑 在水中的溶解)。则下列说法正确的是( )
在水中的溶解)。则下列说法正确的是( )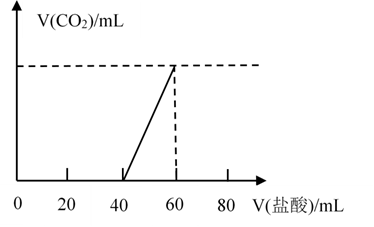
A . 滴加盐酸之前,原溶液所含溶质可能是NaOH和 B . 当V(盐酸)=60mL时,产生
B . 当V(盐酸)=60mL时,产生 的体积(标准状况)为44.8mL
C . 滴加60mL盐酸充分反应后,所得溶液中
的体积(标准状况)为44.8mL
C . 滴加60mL盐酸充分反应后,所得溶液中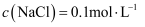 D . 当
D . 当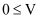 (盐酸)
(盐酸) mL时,反应的离子反应方程式仅是:
mL时,反应的离子反应方程式仅是:
 B . 当V(盐酸)=60mL时,产生
B . 当V(盐酸)=60mL时,产生 的体积(标准状况)为44.8mL
C . 滴加60mL盐酸充分反应后,所得溶液中
的体积(标准状况)为44.8mL
C . 滴加60mL盐酸充分反应后,所得溶液中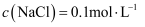 D . 当
D . 当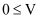 (盐酸)
(盐酸) mL时,反应的离子反应方程式仅是:
mL时,反应的离子反应方程式仅是:
最近更新






