物质的量浓度 知识点题库
用10mL 0.1mol/L的BaCl2溶液可分别使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的SO42﹣完全转化为BaSO4沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A . 3:2:2
B . 1:2:3
C . 1:3:3
D . 3:1:1
将80克NaOH溶解于水,配成5L溶液,则NaOH的物质的量浓度是.
150mL Fe2(SO4)3溶液中含Fe3+ 5.6g,溶液中SO42﹣的物质的量浓度是
9.5gMgCl2固体溶于水配成500mL溶液,其溶质的物质的量为,其浓度为 mol•L﹣1 , 从中取出100mL溶液,其中Cl﹣的浓度为 mol•L
﹣1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为mol•L﹣1
下列溶液中氢离子浓度最小的是( )
A . 10L0.10mol/LCH3COOH 溶液
B . 2L 0.05mol/L H2SO4溶液
C . 1L0.10mol/LHNO3溶液
D . 2L0.1mol/LHCl溶液
下列溶液中氯离子的浓度与50mL 1mol/L的AlCl3溶液中氯离子浓度相等的是( )
A . 150mL1mol/L NaCl溶液
B . 75mL2mol/L NH4Cl溶液
C . 150mL3mol/L KCl溶液
D . 75mL1mol/L CuCl2溶液
标准状况下,1L水能溶解VL氨气,若所得溶液的密度为dg/cm3 , 则所得氨水的物质的量浓度为(溶质以NH3为标准)( )
A .  mol/L
B .
mol/L
B . 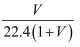 mol/L
C .
mol/L
C . 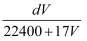 mol/L
D .
mol/L
D . 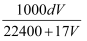 mol/L
mol/L
 mol/L
B .
mol/L
B . 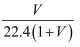 mol/L
C .
mol/L
C . 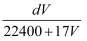 mol/L
D .
mol/L
D . 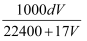 mol/L
mol/L
在100 mL 0.10 mol/L的 AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.010 mol CuSO4 · 5H2O的溶液,充分反应。下列说法中正确的是( )
A . 最终得到白色沉淀和无色溶液
B . 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C . 在最终得到的溶液中,Cl-的物质的量为0.02 mol
D . 在最终得到的溶液中,Cu2+的物质的量浓度为0.10 mol/L
在400mL某硫酸盐溶液中,含有3.0NA个SO42- (NA表示阿伏加德罗常数的值),同时含有2.0NA个金属离子。则该硫酸盐的物质的量浓度为( )
A . 1mol/L
B . 2.5mol/L
C . 5mol/L
D . 2mol/L
将6.4g 铜加入到50mL a mol/L的硝酸溶液中,铜全部溶解,得到NO2和NO的混合气体.将反应后溶液稀释至100mL,测得NO3-的浓度为3mol/L.
-
(1) 混合气体中NO2和NO的总物质的量为多少mol(用含a的式子表示).
-
(2) 稀释后的溶液中H+的物质的量浓度为多少mol/L
NA表示阿伏加德罗常数的数值,下列说法正确的是()
A . 标准状况下,22.4LCHCl3含有的分子数目为NA
B . 3.4g羟基(-OH)含有2NA个电子
C . 1L0.1mol/L甘氨酸( 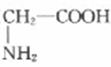 )溶液中含有的氧原子数为0.2NA
D . 0.5molC4H10中含有的非极性共价键数目为1.5NA
)溶液中含有的氧原子数为0.2NA
D . 0.5molC4H10中含有的非极性共价键数目为1.5NA
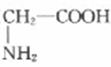 )溶液中含有的氧原子数为0.2NA
D . 0.5molC4H10中含有的非极性共价键数目为1.5NA
)溶液中含有的氧原子数为0.2NA
D . 0.5molC4H10中含有的非极性共价键数目为1.5NA
阿伏加德罗常数的值为NA , 下列叙述中不正确的是( )
①标准状况下,2.24L水中含有0.1NA个水分子
②常温常压下,32gSO2含有的分子数为0.5NA
③2molNaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤1molNa2O2与足量的CO2反应转移的电子数为NA
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2L氯气中含有NA个氯原子
⑨在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑩标准状况下14gCO含有的核外电子数为10NA
A . 4个
B . 5个
C . 6个
D . 7个
下列溶液中,跟 100 mL 0.5 mol•L-1 NaCl 溶液中所含的 Cl-物质的量浓度相同的是( )
A . 100 mL 0.5 mol•L-1 MgCl2溶液
B . 200 mL 0.25 mol•L-1 AlCl3溶液
C . 50 mL 1 mol•L-1 NaCl 溶液
D . 25 mL 0.5 mol•L-1 HCl 溶液
-
(1) 25℃时,0.05mol/L H2SO4溶液的pH=
-
(2) 某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)= ;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)= 。
-
(3) 氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1 , 如要生成Cu(OH)2沉淀,应调整溶液使之pH>
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1 , 如要生成Cu(OH)2沉淀,应调整溶液使之pH>
-
(4) 向明矾溶液中逐滴加入Ba(OH) 2溶液至硫酸根离子刚好完全沉淀时,溶液的pH7(填>、<、=),离子反应总方程式向明矾溶液中逐滴加入Ba(OH) 2溶液至铝离子刚好完全沉淀时,溶液的pH7(填>、<、=),离子反应总方程式
将4molA气体和2molB气体充入到1L的密闭容器中,在一定条件下发生如下反应:2A(g)+ B(g)⇌2C(g)。经2s后达到平衡时,测得C的物质的量为1.2 mol。下列说法中正确的是( )
A . 平衡时,A物质的浓度为2.8 mol·L-1
B . 平衡时,B的转化率为70%
C . 反应后混合气体的总物质的量为5.2mol
D . 用C表示平均反应速率为1.2mol·L-1·s-1
用18.4mol/L的浓硫酸20mL和铜共热一段时间后,待反应混合物冷却,滤去多余的铜,将滤液加水定容到100mL,所得  离子浓度为2.68mol/L,则下列说法错误的是( )
离子浓度为2.68mol/L,则下列说法错误的是( )
 离子浓度为2.68mol/L,则下列说法错误的是( )
离子浓度为2.68mol/L,则下列说法错误的是( )
A . 溶解的铜的质量为6.4g
B . 生成的SO2在标况下为2.24L
C . 反应中消耗的硫酸为0.1mol
D . 反应后c(CuSO4)为1.0mol/L
将标准状况下的HCl气体4.48 L溶于水配成100 mL溶液,然后与足量的铁屑充分反应。计算:
-
(1) 所得盐酸的物质的量浓度。
-
(2) 将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度是。
将 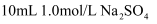 溶液加水稀释至
溶液加水稀释至 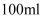 ,稀释后
,稀释后  的物质的量浓度为( )
的物质的量浓度为( )
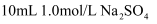 溶液加水稀释至
溶液加水稀释至 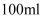 ,稀释后
,稀释后  的物质的量浓度为( )
的物质的量浓度为( )
A . 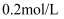 B .
B . 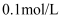 C .
C . 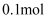 D .
D . 
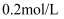 B .
B . 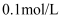 C .
C . 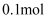 D .
D . 
NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A . 标准状况下,22.4LH2O中含有的分子数为NA
B . 标准状况下,33.6LNH3溶于1L水中,得到氨水物质的量浓度为1.5mol/L
C . 通常状况下, 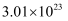 个CO占有的体积为11.2L
D . 常温常压下,56gCO和N2的混合气体所含原子数为4NA
个CO占有的体积为11.2L
D . 常温常压下,56gCO和N2的混合气体所含原子数为4NA
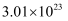 个CO占有的体积为11.2L
D . 常温常压下,56gCO和N2的混合气体所含原子数为4NA
个CO占有的体积为11.2L
D . 常温常压下,56gCO和N2的混合气体所含原子数为4NA
向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积关系如图所示。下列判断正确的是( )

A . 在0~a范围内,只发生中和反应
B . ab段发生反应的离子方程式为  +2H+=CO2↑+H2O
C . a=0.3
D . 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
+2H+=CO2↑+H2O
C . a=0.3
D . 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
 +2H+=CO2↑+H2O
C . a=0.3
D . 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
+2H+=CO2↑+H2O
C . a=0.3
D . 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
最近更新



