质量守恒定律 知识点题库

 2CO2+4H2O则由此得出的下列结论,完全正确的一组是( )
2CO2+4H2O则由此得出的下列结论,完全正确的一组是( ) ①R由碳、氢两种元素组成
②R中碳元素的质量分数是37.5%
③6.4gR燃烧还生成了7.2gH2O
④R的相对分子质量等于64.
物质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量/g | 4 | 10 | 1 | 25 |
反应后的质量/g | 未测定 | 21 | 10 | 9 |
已知丁的相对分子质量为甲的2倍,则该反应的化学方程式中甲与丁的化学计量数的比为( )
-
(1) 碳的氧化物可用来制备碳酰肼[
 ,其中碳元素为
,其中碳元素为 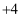 价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为.
价].加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳.该反应的化学方程式为.
-
(2) 控制城市空气污染源的方法可以有_________(多选)A . 开发新能源 B . 使用电动车 C . 植树造林 D . 戴上呼吸面具
-
(3)
 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如
有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如 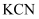 ),经以下反应实现:
),经以下反应实现:  ,则生成物A的化学式为.
,则生成物A的化学式为.
-
(4) 火法炼铅的废气中含低浓度
 ,可将废气通入过量氨水中进行处理,反应的离子方程式为.
,可将废气通入过量氨水中进行处理,反应的离子方程式为.
-
(5) 取
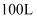 某钛液,加铝粉,使其发生反应
某钛液,加铝粉,使其发生反应  (未配平),反应消耗铝
(未配平),反应消耗铝 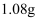 ,则该钛液中
,则该钛液中  的物质的量浓度为.
的物质的量浓度为.
-
(6) 工业上利用纳米
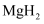 和
和 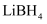 组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:.
组成的体系储放氢(如图所示).写出放氢过程中发生反应的化学方程式:. 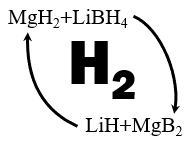
-
(7) 工业上可以采用热还原法制备金属镁(沸点107℃,熔点648.8℃).将碱式碳酸镁
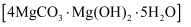 和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体).
和焦炭按一定比例混合,放入真空管式炉中先升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体). 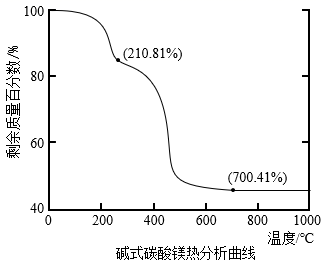
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是.
②碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:.
-
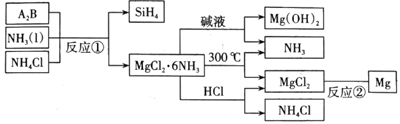
(1) Si在元素周期表中的位置是,NH3的电子式为。
-
(2) A2B的化学式为,上图中可以循环使用的物质有。
-
(3) 在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料:(填化学式),其中含有的化学键类型是。
-
(4) 单质硼可用于生成具有优良抗冲击性能的硼钢。以硼酸(H3BO3)和金属镁为原料在加热条件下制备单质硼,用化学方程式表示其制备过程:、。
-
(1) I.氮元素的化合物种类繁多,研究氮氧化物的反应机理对于消除污染有重要指导作用。
可用O3氧化法处理氮氧化物,已知:
①2NO(g)+O2(g)=2NO2(g) ΔH1=-113kJ/mol
②4NO2(g)+O2(g)=2N2O5(g) ΔH2=-57kJ/mol
③6NO2(g)+O3(g)=3N2O5(g) ΔH2=-227kJ/mol
用O3氧化脱除NO的总反应是:NO(g)+O3(g)=NO2(g)+O2(g) ΔH4=。
-
(2) 用NH3催化还原氮氧化物(SCR)技术是常见的烟气氮氧化物脱除技术,反应原理如图。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。写出该反应的化学方程式。

-
(3) II.CO2的回收与利用
由CO2转化为羧酸是CO2资源化利用的重要方法。在催化作用下CO2和CH4合成CH3COOH的化学方程式为;在合成CH3COOH的反应中,下列有关说法正确的是(填字母序号)。
A.利用催化剂可以提高反应物的转化率
B.有22.4LCH4(标况)参与反应时转移4mol电子
C.CH4→CH3COOH过程中,所有的化学键都发生断裂
D.该反应为放热反应
-
(4) CO2和H2合成甲醇也是CO2资源化利用的重要方法。测得平衡时甲醇产率与反应温度、压强的关系如图所示。

①已知该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(l) ΔH=-130.9kJ/mol,此反应的活化能E(a)正E(a)逆(填“>”或“<”)。
②下列措施不能使CO2的平衡转化率提高的是(填字母序号)。
A.改用更高效的催化剂
B.增大H2与CO2的投料比
C.升高温度D.增大压强
③200℃时,将2molCO2和4molH2充入2L密闭容器中,在催化作用下反应达到平衡。若平衡时CO2的转化率为50%,则此温度下该反应的平衡常数K=(已知CH3OH的沸点为64.7℃)。
 温度下,向2L真空密闭容器中加入
温度下,向2L真空密闭容器中加入  固体,发生反应:
固体,发生反应:  (未配平),反应过程如图,下列说法正确的是( )
(未配平),反应过程如图,下列说法正确的是( ) 
 B .
B .  用
用  表示的反应速率为
表示的反应速率为  C . 第2min时逆反应速率大于第4min时逆反应速率
D . 第4min时,保持温度和容积不变,向容器中再加入
C . 第2min时逆反应速率大于第4min时逆反应速率
D . 第4min时,保持温度和容积不变,向容器中再加入  ,混合气体颜色加深
,混合气体颜色加深
 的物质的量为( )
的物质的量为( )
-
(1) Ⅰ.装置如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答:

若AB电源是甲醇在酸性环境的燃料电池,则甲中C极的电极反应式为。
-
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成,对应单质的物质的量之比为。
-
(3) 丙是一个给铜件镀银的装置,当乙中溶液的c(OH-)=0.1mol/L时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为 g。
-
(4) Ⅱ.某同学用稀硝酸和铜反应制NO,发现化学反应速率较慢,因此改用浓硝酸按下图所示装置制取NO。

浓硝酸一般盛放在棕色试剂瓶中,原因是。
-
(5) B中反应的化学方程式是。
 B .
B .  C .
C .  D .
D . 
 可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。
可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21。 分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在
分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在 以下热分解时无刺激性气体逸出。下列叙述正确的是( )
以下热分解时无刺激性气体逸出。下列叙述正确的是( )
 C .
C .  阶段热分解失去4个
阶段热分解失去4个 D .
D .  热分解后生成固体化合物
热分解后生成固体化合物



