高一化学试题
已知31.6g的KMnO4与过量的浓盐酸完全反应,化学方程式为:KMnO4+HCl═KCl+MnCl2+Cl2↑+H2O,回答下列问题:
-
(1) 写出配平后的正确化学方程式.
-
(2) 指出该反应中盐酸的作用?
-
(3) 氧化剂与还原剂的物质的量之比是多少?
-
(4) 产生的Cl2在标准状况下的体积是多少?(要有必要解题过程)
根据反应:2Fe+3Cl2 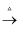 2FeCl3 , 当28gFe在71gCl2中点燃时( )
2FeCl3 , 当28gFe在71gCl2中点燃时( )
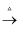 2FeCl3 , 当28gFe在71gCl2中点燃时( )
2FeCl3 , 当28gFe在71gCl2中点燃时( )
A . Fe和Cl2恰好完全反应
B . 生成99gFeCl3
C . 会有9.33gFe过量
D . 会有17.75gCl2过量
一块表面已被氧化成氧化钠的钠块(质量为  )投入足量的水中,产生
)投入足量的水中,产生  气体,则原来被氧化的钠的质量是( )
气体,则原来被氧化的钠的质量是( )
 )投入足量的水中,产生
)投入足量的水中,产生  气体,则原来被氧化的钠的质量是( )
气体,则原来被氧化的钠的质量是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
已知MnO2与浓盐酸可以发生如下反应:
4HCl(浓)+MnO2 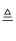 MnCl2+Cl2↑+2H2O,若产生7.1gCl2 , 则:
MnCl2+Cl2↑+2H2O,若产生7.1gCl2 , 则:
-
(1) 参加反应的HCl是多少克?
-
(2) 被氧化的HCl是多少克?
-
(3) 参加反应的MnO2物质的量是多少?
标准状况下,某气态烃A的密度是1.25g·L-1 , 取x L的A在足量的氧气中充分燃烧,生成的混合气体通入到50mLNaOH溶液,随后取此溶液25mL将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L-1的HCl溶液,产生的CO2气体体积与所加入的盐酸的体积之间的关系如图所示:

-
(1) A的摩尔质量为。
-
(2) 请计算x的值(写出具体计算过程)。
把aL一个大气压,120℃的氢气氧气混合于密闭容器中,电火花引爆后恢复至原状态,测得体积为bL,则下列表述不可能正确的是( )
A . 2a=3b
B . 7b=4a
C . 原混合气体中V(H2)=bL,V(O2)=(a﹣b)L
D . 原混合气体中V(H2)=2(a﹣b)L,V(O2)=(2b﹣a)L
某工厂的燃料煤中硫的质量分数为0.32%,该工厂每天燃烧这种煤10t,计算:
-
(1) 如果煤中的硫全部转化为SO2 , 每天可产生的SO2的质量为多少t;
-
(2) 这些SO2在标准状况下的体积.
取25.0gCuSO4•5H2O晶体,加热使之均匀、缓慢升温至1000℃并恒温1小时,试通过计算回答下列问题(如果是混合物,要算出混合物中各组分的质量):
-
(1) 在某中间温度时,固体产物质量是否可能为10g?
-
(2) 不考虑实验带来的误差,在反应条件下,反应气态产物除去水后,物质的量可能为A . 0mol B . 0.1mol C . 大于0.1mol
-
(3) 你认为最终固体产物为多少克?产物颜色如何?
-
(4) 如果某同学做此实验时最后固体质量为7.6g,试计算其组分.
在反应3BrF3+5H2O=9HF+Br2+HBrO3+O2↑中,若有5molH2O参加反应,被水还原的溴元素为( )
A . 1 mol
B . 2/3 mol
C . 4/3mol
D . 2mol
CO与水蒸气的混合气体10g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为5.2g,则原混合气体中CO的质量分数为( )
A . 28%
B . 46%
C . 56%
D . 64%
12C和14C互为( )
A . 同分异构体
B . 同位素
C . 同系物
D . 同素异形体
常温下A和B两种气体组成的混合气体(A的相对分子质量大于B的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于 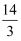 .由此可确定A为,B为,其理由是.
.由此可确定A为,B为,其理由是.
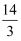 .由此可确定A为,B为,其理由是.
.由此可确定A为,B为,其理由是. 若上述混合气体的氮和氢的质量比为7:1,则在混合气体中A和B的物质的量之比为,A在混合气体中的体积分数为.
某火力发电厂使用的燃料煤中硫的质量分数为0.32%.该电厂每天要燃烧这种煤200t,请通过计算回答:
-
(1) 如果煤中的硫全部转化为SO2 , 该电厂每天燃烧产生SO2多少升(标准状况)?
-
(2) 将SO2用“钙基固硫法”处理可以“变废为宝”:SO2
 CaSO3
CaSO3  CaSO4
CaSO4假设转化过程的损失可以忽略不计,计算该电厂每天用“钙基固硫法”处理产生的SO2 , 可获得纯度为85%的CaSO4多少吨?
下列微粒互为同位素的是( )
A . O2和O3
B . 1H+和 2H+
C . Cl和Cl﹣
D . 氘和氚
常温下,1mol某气态烃CxHy完全燃烧需要氧气5mol,则x与y之和可能是( )
A . x+y=5
B . x+y=7
C . x+y=11
D . x+y=13
在100ml
1mol/L的AlCl3溶液中滴加的1mol/L
NaOH溶液可得到3.9沉淀,则消耗的NaOH溶液的体积是多少?
把19.2g的Cu放入足量的稀硝酸中,至Cu完全反应.已知:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O求:
-
(1) 参加反应的硝酸的物质的量是多少?
-
(2) 反应结束后溶液加水到500ml,这时硝酸铜的物质的量浓度是多少?
16O与18O互为同位素,下列说法正确的是( )
A . 16O与18O具有相同的物理性质
B . 16O与18O具有不同的电子数
C . 16O与18O具有相同的质子数
D . 16O2与18O3互为同位素
标准状况下,某同学向 100mL H2S 饱和溶液中通入SO2 , 所得溶液 pH 变化如图所示.下列分析中,正确的是( )

A . ab 段反应是:SO2+2 H2S=3S↓+2 H2O
B . 亚硫酸是比氢硫酸更弱的酸
C . 原H2S溶液的物质的量浓度为0.05 mol•L﹣1
D . b 点对应的溶液导电性最强
称取8.00 g氧化铜和氧化铁固体混合物,加入100 mL2.00mol/L的硫酸充分溶解,往所得溶液中加11.2g铁粉,充分反应后,得固体的质量为6.08g。请计算:
-
(1) 加入铁粉充分反应后,溶液中溶质的物质的量。
-
(2) 固体混合物中氧化铜的质量。
最近更新



