й«ҳдёҖеҢ–еӯҰпјҡ дёҠеӯҰжңҹдёҠеҶҢгҖҖгҖҖдёӢеӯҰжңҹдёӢеҶҢ
й«ҳдёҖеҢ–еӯҰиҜ•йўҳ
зӯүиҙЁйҮҸ并且еқҮиҝҮйҮҸзҡ„дёӨд»Ҫй”ҢзІүaе’ҢbпјҲзІүжң«иЎЁйқўз§ҜеҸҜи§ҶдёәзӣёеҗҢпјҢеҲҶеҲ«еҠ е…ҘзӯүдҪ“з§Ҝзӯүзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„зЁҖзЎ«й…ёдёӯпјҢеҗҢж—¶еҗ‘aдёӯеҠ е…Ҙе°‘йҮҸзЎ«й…ёй“ңпјҢеӣҫиЎЁзӨәдә§з”ҹH2зҡ„дҪ“з§ҜпјҲVпјүдёҺж—¶й—ҙпјҲtпјүзҡ„е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
A . 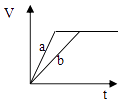 B .
B . 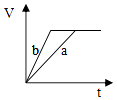 C .
C .  D .
D . 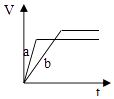
 B .
B .  C .
C .  D .
D . 
дёӢеҲ—жңүе…і230Thе’Ң232Thзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 230Thе’Ң232Thзҡ„ж ёеӨ–з”өеӯҗж•°дёҚеҗҢ
B . 230Thе’Ң232Thзҡ„еҢ–еӯҰжҖ§иҙЁдёҚеҗҢ
C . 230Thе’Ң232Thдә’дёәеҗҢдҪҚзҙ
D . 230Thе’Ң232ThжҳҜеҗҢдёҖз§Қж ёзҙ
жңү0.4g й“Ғзҡ„ж°§еҢ–зү©пјҢз”Ёи¶ійҮҸзҡ„COеңЁй«ҳжё©дёӢе°Ҷе…¶иҝҳеҺҹпјҢжҠҠз”ҹжҲҗзҡ„CO2е…ЁйғЁйҖҡе…Ҙи¶ійҮҸжҫ„жё…зҹізҒ°ж°ҙдёӯпјҢеҫ—еҲ°0.75g жІүж·ҖгҖӮиҝҷз§Қй“Ғзҡ„ж°§еҢ–зү©зҡ„еҢ–еӯҰејҸжҳҜпјҹ
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯиЎЁзӨәй”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . дёӯеӯҗж•°дёә10зҡ„ж°§еҺҹеӯҗпјҡ B . ж°ҜзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
B . ж°ҜзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ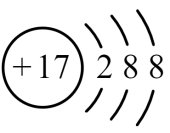 C . з”Ізғ·зҡ„зҗғжЈҚжЁЎеһӢпјҡ
C . з”Ізғ·зҡ„зҗғжЈҚжЁЎеһӢпјҡ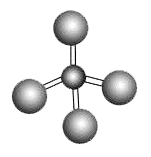 D .
D .  зҡ„з»“жһ„ејҸпјҡ
зҡ„з»“жһ„ејҸпјҡ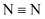
 B . ж°ҜзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
B . ж°ҜзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ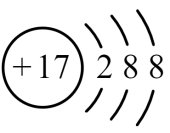 C . з”Ізғ·зҡ„зҗғжЈҚжЁЎеһӢпјҡ
C . з”Ізғ·зҡ„зҗғжЈҚжЁЎеһӢпјҡ D .
D .  зҡ„з»“жһ„ејҸпјҡ
зҡ„з»“жһ„ејҸпјҡ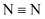
AпјҢBдёӨз§Қзғғзҡ„ж··еҗҲзү©пјҢеҪ“ж··еҗҲзү©зҡ„иҙЁйҮҸдёҖе®ҡж—¶пјҢж— и®әAпјҢBд»ҘдҪ•з§ҚжҜ”дҫӢж··еҗҲпјҢе®Ңе…ЁзҮғзғ§дә§з”ҹзҡ„CO2зҡ„йҮҸеқҮзӣёзӯүпјҺеңЁв‘ еҗҢеҲҶејӮжһ„дҪ“пјҢв‘ЎеҗҢзі»зү©пјҢв‘ўе…·жңүзӣёеҗҢзҡ„жңҖз®ҖејҸпјҢв‘Јеҗ«зўізҡ„иҙЁйҮҸеҲҶж•°зӣёеҗҢпјҢз¬ҰеҗҲдёҠиҝ°жқЎд»¶зҡ„з»„еҗҲжҳҜпјҲВ В пјү
A . в‘ в‘Ўв‘Ј
B . в‘ в‘ўв‘Ј
C . в‘Ўв‘ўв‘Ј
D . в‘ в‘Ўв‘ў
зӣёеҗҢиҙЁйҮҸзҡ„дёӢеҲ—еҗ„зғғпјҢе®Ңе…ЁзҮғзғ§еҗҺз”ҹжҲҗCO2жңҖеӨҡзҡ„жҳҜпјҲВ В пјү
A . з”Ізғ·
B . д№ҷзғ·
C . д№ҷзғҜ
D . д№ҷзӮ”
е°ҶдёҖе®ҡиҙЁйҮҸзҡ„MgгҖҒFeгҖҒAlж··еҗҲзү©дёҺи¶ійҮҸзЁҖH2SO4еҸҚеә”пјҢз”ҹжҲҗH211.2LпјҲж ҮеҮҶзҠ¶еҶөпјүпјҢеҺҹж··еҗҲзү©зҡ„иҙЁйҮҸеҸҜиғҪжҳҜпјҲВ В пјү
A . 35.7g
B . 30g
C . 17g
D . 9g
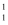 HгҖҒ
HгҖҒ 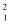 HгҖҒ
HгҖҒ 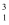 HгҖҒH+гҖҒH2жҳҜ пјҲ пјү
HгҖҒH+гҖҒH2жҳҜ пјҲ пјү
A . ж°ўзҡ„дә”з§ҚеҗҢдҪҚзҙ
B . дә”з§Қж°ўе…ғзҙ
C . ж°ўзҡ„дә”з§Қж ёзҙ
D . ж°ўе…ғзҙ зҡ„дә”з§ҚдёҚеҗҢзІ’еӯҗ
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯиЎЁзӨәдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . Na2Oзҡ„з”өеӯҗејҸпјҡ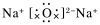 B . CO2зҡ„з»“жһ„ејҸпјҡO-C-O
C . H2Oзҡ„еҲҶеӯҗз»“жһ„жЁЎеһӢпјҡ
B . CO2зҡ„з»“жһ„ејҸпјҡO-C-O
C . H2Oзҡ„еҲҶеӯҗз»“жһ„жЁЎеһӢпјҡ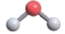 D . S2-зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
D . S2-зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
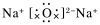 B . CO2зҡ„з»“жһ„ејҸпјҡO-C-O
C . H2Oзҡ„еҲҶеӯҗз»“жһ„жЁЎеһӢпјҡ
B . CO2зҡ„з»“жһ„ејҸпјҡO-C-O
C . H2Oзҡ„еҲҶеӯҗз»“жһ„жЁЎеһӢпјҡ D . S2-зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
D . S2-зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ
жҹҗзІ’еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫдёә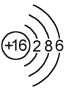 пјҢ е…ідәҺиҜҘзІ’еӯҗзҡ„иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
пјҢ е…ідәҺиҜҘзІ’еӯҗзҡ„иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
A . ж ёз”өиҚ·ж•°дёә16
B . ж ёеӨ–жңү3дёӘз”өеӯҗеұӮ
C . еұһдәҺйқһйҮ‘еұһе…ғзҙ еҺҹеӯҗ
D . еңЁеҢ–еӯҰеҸҚеә”дёӯе®№жҳ“еӨұеҺ»2дёӘз”өеӯҗ
е°ҶдёҖе®ҡйҮҸзҡ„MgгҖҒAlж··еҗҲзү©жҠ•е…Ҙ200mLжҹҗжө“еәҰзҡ„зӣҗй…ёдёӯпјҢйҮ‘еұһе®Ңе…Ёжә¶и§ЈеҗҺпјҢеҶҚйҖҗж»ҙеҠ е…Ҙ2molвҖўLп№Ј1зҡ„ NaOHжә¶ж¶ІиҮіиҝҮйҮҸпјҢжүҖз”ҹжҲҗзҡ„жІүж·ҖдёҺжүҖеҠ NaOHзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҡ

-
пјҲ1пјү 0пҪһ50mLж®өеҶ…пјҢеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺ
-
пјҲ2пјү 300пҪһ350mLж®өеҶ…пјҢеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺ
-
пјҲ3пјү иҜ•и®Ўз®—иҜҘзӣҗй…ёзҡ„жө“еәҰпјҺпјҲеҶҷеҮәеҝ…иҰҒзҡ„и®Ўз®—иҝҮзЁӢпјүпјҺ
еӨ©жҙҘжёҜзҲҶзӮёиҮҙеӨ§йҮҸж°°еҢ–й’ пјҲNaCNпјүжі„йңІпјҢNaCNжҳҜеү§жҜ’зү©иҙЁпјҺ专家们дҪҝз”ЁеҸҢж°§ж°ҙпјҲH2O2пјүжқҘеӨ„зҗҶж°°еҢ–й’ пјҢеҸҚеә”ж–№зЁӢејҸеҰӮдёӢпјҡH2O2+NaCN+H2Oв•җNaHCO3+NH3
-
пјҲ1пјү иӢҘжңү0.49еҗЁ NaCNжі„йңІиҮіе°‘йңҖиҰҒиҙЁйҮҸеҲҶж•°дёә34%зҡ„H2O2жә¶ж¶ІеҗЁиҝӣиЎҢеӨ„зҗҶ
пјҲеҒҮи®ҫH2O2зҡ„еӨ„зҗҶж•ҲжһңжҳҜ100%пјҢдё”дёҚиҖғиҷ‘H2O2иҮӘиә«еҲҶи§Јпјү
-
пјҲ2пјү зӣёжҜ”дәҺеҸҢж°§ж°ҙпјҢжјӮзҷҪзІүпјҲдё»иҰҒжҲҗеҲҶCaпјҲClOпјү2пјүзҡ„д»·ж јиҰҒдҫҝе®ңзҡ„еӨҡпјҢиӢҘеӨ„зҗҶзӣёеҗҢиҙЁйҮҸзҡ„NaCNпјҲз”ҹжҲҗзү©зӣёеҗҢпјүйңҖиҰҒж¶ҲиҖ—CaпјҲClOпјү2molпјҲеҒҮи®ҫCaпјҲClOпјү2зҡ„еӨ„зҗҶж•ҲжһңжҳҜ100%пјү
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—жңүе…іеҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 5.6Lз”Ізғ·еҗ«жңүзҡ„е…ұд»·й”®ж•°дёәNA
B . 2gD2l6Oе’Ң2gH218Oдёӯеҗ«жңүзҡ„дёӯеӯҗж•°еқҮдёәNA
C . иҝҮж°§еҢ–й’ дёҺж°ҙеҸҚеә”ж—¶пјҢз”ҹжҲҗ0.1molж°§ж°”иҪ¬з§»зҡ„з”өеӯҗж•°дёә0.4NA
D . еёёжё©дёӢpH=13зҡ„Ba(OH)2жә¶ж¶Ідёӯеҗ«жңүзҡ„OH-зҰ»еӯҗж•°дёә0.1NA
зӣёеҗҢзўіеҺҹеӯҗж•°зҡ„зғ·зғғгҖҒзғҜзғғгҖҒзӮ”зғғпјҢеңЁз©әж°”дёӯе®Ңе…ЁзҮғзғ§з”ҹжҲҗдәҢж°§еҢ–зўіе’Ңж°ҙпјҢйңҖиҰҒз©әж°”йҮҸзҡ„жҜ”иҫғдёӯжӯЈзЎ®жҳҜпјҲВ В пјү
A . зғ·зғғжңҖеӨҡ
B . зғҜзғғжңҖеӨҡ
C . зӮ”зғғжңҖеӨҡ
D . дёүиҖ…дёҖж ·еӨҡ
дёӢеҲ—еҢ–еӯҰз”ЁиҜӯиЎЁзӨәжӯЈзЎ®зҡ„жҳҜ( )
A . S2- зҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ 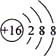 B . д№ҷй…ёзҡ„з»“жһ„з®ҖејҸпјҡ C2H4O2
C . дёӯеӯҗж•°дёә20зҡ„ж°ҜеҺҹеӯҗпјҡ
B . д№ҷй…ёзҡ„з»“жһ„з®ҖејҸпјҡ C2H4O2
C . дёӯеӯҗж•°дёә20зҡ„ж°ҜеҺҹеӯҗпјҡ 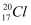 D . дәҢж°§еҢ–зўіеҲҶеӯҗзҡ„жҜ”дҫӢжЁЎеһӢжҳҜпјҡ
D . дәҢж°§еҢ–зўіеҲҶеӯҗзҡ„жҜ”дҫӢжЁЎеһӢжҳҜпјҡ 
 B . д№ҷй…ёзҡ„з»“жһ„з®ҖејҸпјҡ C2H4O2
C . дёӯеӯҗж•°дёә20зҡ„ж°ҜеҺҹеӯҗпјҡ
B . д№ҷй…ёзҡ„з»“жһ„з®ҖејҸпјҡ C2H4O2
C . дёӯеӯҗж•°дёә20зҡ„ж°ҜеҺҹеӯҗпјҡ 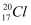 D . дәҢж°§еҢ–зўіеҲҶеӯҗзҡ„жҜ”дҫӢжЁЎеһӢжҳҜпјҡ
D . дәҢж°§еҢ–зўіеҲҶеӯҗзҡ„жҜ”дҫӢжЁЎеһӢжҳҜпјҡ
зЎ«жңүеӨҡз§Қеҗ«ж°§й…ёпјҢдәҡзЎ«й…ёпјҲH2SO3пјүгҖҒзЎ«й…ёпјҲH2SO4пјүгҖҒз„ҰзЎ«й…ёпјҲH2SO4В·SO3пјүгҖҒзЎ«д»ЈзЎ«й…ёпјҲH2S2O3пјүзӯүзӯүпјҢе…¶дёӯзЎ«й…ёжңҖдёәйҮҚиҰҒпјҢеңЁе·ҘдёҡдёҠжңүе№ҝжіӣзҡ„еә”з”ЁпјҺеңЁе®һйӘҢе®ӨпјҢжө“зЎ«й…ёжҳҜеёёз”Ёзҡ„е№ІзҮҘеүӮпјҺе®ҢжҲҗдёӢеҲ—и®Ўз®—пјҡ
-
пјҲ1пјү з„ҰзЎ«й…ёпјҲH2SO4 пјҺ SO3пјүжә¶дәҺж°ҙпјҢе…¶дёӯзҡ„SO3йғҪиҪ¬еҢ–дёәзЎ«й…ёпјҺиӢҘе°Ҷ445gз„ҰзЎ«й…ёжә¶дәҺж°ҙй…ҚжҲҗ4.00LзЎ«й…ёпјҢиҜҘзЎ«й…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә mol/LпјҺ
-
пјҲ2пјү иӢҘд»Ҙжө“зЎ«й…ёеҗёж°ҙеҗҺз”ҹжҲҗH2SO4 пјҺ H2Oи®Ўз®—пјҢ250gиҙЁйҮҸеҲҶж•°дёә98%зҡ„зЎ«й…ёиғҪеҗёж”¶еӨҡе°‘gж°ҙпјҹ
-
пјҲ3пјү зЎ«й“ҒзҹҝжҳҜе·ҘдёҡдёҠеҲ¶зЎ«й…ёзҡ„дё»иҰҒеҺҹж–ҷпјҺзЎ«й“Ғзҹҝж°§еҢ–з„ҷзғ§зҡ„еҢ–еӯҰеҸҚеә”еҰӮдёӢпјҡ
3FeS2+8O2вҶ’Fe3O4+6SO2 4FeS2+11O2вҶ’2Fe2O3+8SO2
иӢҘ48molFeS2е®Ңе…ЁеҸҚеә”иҖ—з”Ёж°§ж°”2934.4LпјҲж ҮеҮҶзҠ¶еҶөпјүпјҢи®Ўз®—еҸҚеә”дә§зү©дёӯFe3O4дёҺFe2O3зү©иҙЁзҡ„йҮҸд№ӢжҜ”пјҺ
-
пјҲ4пјү з”ЁзЎ«еҢ–ж°ўеҲ¶еҸ–зЎ«й…ёпјҢж—ўиғҪе……еҲҶеҲ©з”Ёиө„жәҗеҸҲиғҪдҝқжҠӨзҺҜеўғпјҢжҳҜдёҖз§ҚеҫҲжңүеҸ‘еұ•еүҚйҖ”зҡ„еҲ¶еӨҮзЎ«й…ёзҡ„ж–№жі•пјҺ
зЎ«еҢ–ж°ўдҪ“з§ҜеҲҶж•°дёә0.84зҡ„ж··еҗҲж°”дҪ“пјҲH2SгҖҒH2OгҖҒN2пјүеңЁз©әж°”дёӯе®Ңе…ЁзҮғзғ§пјҢиӢҘз©әж°”иҝҮйҮҸ77%пјҢи®Ўз®—дә§зү©ж°”дҪ“дёӯSO2дҪ“з§ҜеҲҶж•°пјҲж°ҙжҳҜж°”дҪ“пјүпјҺ
е·ІзҹҘз©әж°”з»„жҲҗпјҡN2дҪ“з§ҜеҲҶж•°0.79гҖҒO2дҪ“з§ҜеҲҶж•°0.21пјҺ
ж°§е…ғзҙ жңүдёүз§Қж ёзҙ 16OгҖҒ17OгҖҒ18OпјҢе®ғ们еңЁиҮӘ然з•ҢдёӯжүҖеҚ зҡ„еҺҹеӯҗдёӘж•°зҷҫеҲҶжҜ”еҲҶеҲ«дёәa%гҖҒb%гҖҒc%пјҢеҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . дёҖдёӘ16OеҺҹеӯҗзҡ„иҙЁйҮҸдёә16g
B . 17Oзҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸзәҰдёә17
C . ж°§е…ғзҙ зҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёә 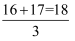 D . ж°§е…ғзҙ зҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёәпјҲ16a%+17b%+18c%пјү
D . ж°§е…ғзҙ зҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёәпјҲ16a%+17b%+18c%пјү
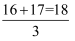 D . ж°§е…ғзҙ зҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёәпјҲ16a%+17b%+18c%пјү
D . ж°§е…ғзҙ зҡ„зӣёеҜ№еҺҹеӯҗиҙЁйҮҸдёәпјҲ16a%+17b%+18c%пјү
жҹҗе…ғзҙ Rзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„еҢ–еӯҰејҸдёәRO2 пјҢ е…¶ж°”жҖҒж°ўеҢ–зү©дёӯж°ўзҡ„иҙЁйҮҸеҲҶж•°дёә25%пјҢжӯӨе…ғзҙ жҳҜпјҲгҖҖгҖҖпјү
A . C
B . N
C . Si
D . S
еңЁ120в„ғпјҢ101kPaж—¶пјҢе°Ҷ1LдёҒзғ·е’ҢиӢҘе№ІеҚҮO2ж··еҗҲпјҢзӮ№зҮғдҪҝд№Ӣе……еҲҶеҸҚеә”пјҺеҸҚеә”еҗҺпјҢжҒўеӨҚеҲ°еҺҹжё©еәҰе’ҢеҺҹеҺӢејәпјҢжөӢеҫ—зҡ„ж°”дҪ“дҪ“з§ҜдёәmLпјҢиӢҘйҖҡиҝҮи¶ійҮҸзўұзҹізҒ°пјҢж°”дҪ“дҪ“з§ҜеҸҳдёәnLпјҺиӢҘmп№Јn=8пјҢеҲҷеҸҚеә”ж¶ҲиҖ—жҺүзҡ„O2дҪ“з§ҜжҳҜпјҲеҗҢжё©еҗҢеҺӢпјүпјҲВ В пјү
A . 5L
B . 5.5L
C . 6L
D . 6.5L
жҹҗй“Ғзҡ„ж°§еҢ–зү©пјҢз”Ё7mol/Lзҡ„зӣҗй…ё100mLеңЁдёҖе®ҡжқЎд»¶дёӢжҒ°еҘҪе®Ңе…Ёжә¶и§ЈпјҢжүҖеҫ—жә¶ж¶ІеҶҚйҖҡе…Ҙ0.56Lж ҮеҮҶзҠ¶еҶөдёӢзҡ„ж°Ҝж°”ж—¶пјҢеҲҡеҘҪдҪҝжә¶ж¶ІдёӯFe2+е®Ңе…ЁиҪ¬еҢ–дёәFe3+ пјҺ еҲҷиҜҘж°§еҢ–зү©зҡ„еҢ–еӯҰејҸеҸҜиЎЁзӨәдёәпјҲВ В пјү
A . FeO
B . Fe3O4
C . Fe4O5
D . Fe5O7
жңҖиҝ‘жӣҙж–°



