高三化学下学期下册试题
化学与生活、生产、环境等社会实际密切相关,下列叙述正确的是( )
A.油脂都不能使溴水褪色
B.稀的食盐水能杀死N7H9禽流感病毒
C.甲壳素、棉花、铜氨纤维、涤纶、光导纤维都是有机高分子材料
D.雾霾会引起呼吸道疾病
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)==TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下
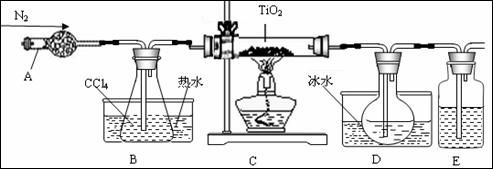
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通入氮气;反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为 (填序号)。欲分离D中的液态混合物,所采用操作的名称是 。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)==FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l)![]() H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
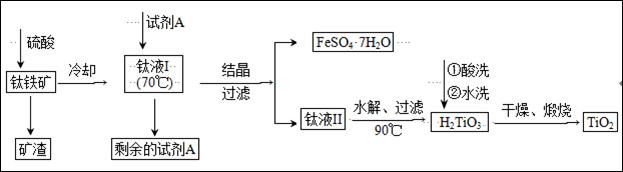
①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
下列关于![]() 的说法中不正确的是
的说法中不正确的是
A. 最多只有5个碳原子在同一直线上 B. 最多有11个碳原子在同一平面上
C. 有7个碳原子可能在同一直线上 D. 最多有19个原子在同一平面上
下列各组物质相互混合后,既有气体生成又有白色沉淀生成的是
①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾[NH4Al(SO4)2]溶液混合 ③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中
A.②④ B.③ c.②③ D.①④
现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m +n ________ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______ (填“变深”“变浅”或“不变”)。
下列有关工业生产的叙述正确的是
A.合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好
B.硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率
C.电解精炼铜时,精铜作阴极
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
在一定温度下,向55 g水中加入一定质量的无水Na2SO3粉末,充分搅拌过滤,得到60 g溶液和一定质量的Na2SO3·7H2O晶体。若此温度下Na2SO3的溶解度为20 g,析出Na2SO3·7H2O晶体的质量为
A.5 g B.10 g
C.15 g D.10.5 g
下列有关苯、乙酸、乙醇说法正确的是
A.都易溶于水
B.苯易挥发不能用作溶剂
C.乙醇和乙酸反应的有机产物的同分异构体中属于酯类的有4种
D.CH3CH2OH![]() CH3CHO发生了加成反应
CH3CHO发生了加成反应
化学与生产、生活息息相关,下列叙述错误的是
A.用活性炭去除冰箱中的异味
B.制饭勺、饭盒、高压锅的不锈钢是合金
C.工业生产玻璃、水泥和陶瓷,均需用石灰石作原料
D.人类超量排放氮氧化物和二氧化硫是形成酸雨的主要原因
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
在同温同压下,在两个容积相同的容器中,一个盛有CO气体,另一个盛有CO2气体,则两容器内的气体一定具有相同的( )
A.密度 B.原子数 C.质量 D.分子数
有一包白色粉末状混合物,可能含有K2CO3、CuSO4、AlCl3、NaOH中的某几种,现进行如下实验:
① 将混合物溶于水,得到无色透明溶液。
② 取少量上述溶液两份:
第一份中加入稀硝酸,开始出现白色沉淀,有气泡产生,继续加入稀硝酸,沉淀全部溶解,再加入AgNO3溶液,又出现白色沉淀;
第二份进行焰色反应,直接观察,火焰呈黄色。
根据上述实验现象回答:
(1)原混合物中肯定有 。
(2)第一份中,继续加入稀硝酸,沉淀全部溶解的离子方程式为 。
(3)第一份中,再加入AgNO3溶液,又出现白色沉淀的离子方程式为 。
(4)第二份进行焰色反应,为什么观察不到K+的焰色反应 。
物质F是合成多种手性药物和生物活性物质的重要中间体,其合成路线如下:

(1)反应①的类型为 ▲ ,反应④的类型为 ▲ 。
(2)物质A聚合可得聚丙炔酸甲酯,其结构简式为 ▲ 。
(3)物质C的俗名为肉桂醛,写出其同时满足下列条件的一种同分异构体的结构简式 ▲ 。
①能与氯化铁溶液显紫色;②苯环上有两个取代基;③分子的核磁共振氢谱有4个峰。
(4)若部分C被氧化为肉桂酸,反应②将产生副产物(分子式为C14H15NO3),写出其结构简式 ▲ 。
(5)已知:![]() ,
,
以 、
、![]() 和
和 为原料,合成
为原料,合成 ,写出合成流程图(无机试剂任用)。合成流程图示例如下:
,写出合成流程图(无机试剂任用)。合成流程图示例如下:![]()
▲
下列有机物相关描述不正确的( )
A.油脂水解可得到氨基酸和甘油
B.甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次递增
C.甘氨酸H2N-CH2COOH、丙氨酸CH3CH(NH2)COO![]() H、谷氨酸HOOCCH2CH2CH(NH2)COOH
H、谷氨酸HOOCCH2CH2CH(NH2)COOH
一定条件下形成链状三肽的结构最多有2×33种
D.分子式为![]() C5H10O2的所有酯类的同分异构体共有9种
C5H10O2的所有酯类的同分异构体共有9种
下列说法正确的是( )
A.向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.在一定温度下AgCl的水溶液中,Ag+和Cl-物质的量浓度的乘积是一个常数
C.25oC时Ksp(AgCl)=l.8![]() 10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI
10-10,Ksp(AgI)=1.0×10-16,因此AgCl可以转化为AgI
D.温度一定时,当溶液中Ag+和Cl-物质的量浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液
据下图的转化关系及现象回答下列问题。

(1)固体X的名称___________;A的化学式____________。
(2)写出反应①②③④的化学方程式
①________________________________;
②________________________________;
③________________________________;
④_________________________________。
M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N。燃烧9.0g的N只产生CO2和H2O,且质量分别为13.2g和5.4g,实验测得N在标准状况下的蒸气密度为4.02g/L;N的核磁共振氢谱显示的峰面积之比为1︰1︰1︰3。
(1)通过计算确定N的分子式。
(2)写出由N在催化剂条件下缩聚反应合成M的化学方程式。
对于化学反应能否自发进行,下列说法中错误的是 ( )
A.若ΔH<0,△S>0,任何温度下都能自发进行
B.若ΔH>0,△S<0,任何温度下都不能自发进行
C.若ΔH>0,△S>0,低温时可自发进行
D.若ΔH<0,△S<0,低温时可自发进行
下列溶液中Cl-的物质的量浓度最大的是
A、200mL 2.5mol/L MgCl2溶液 B、1000mL 4mol/L NaCl溶液
C、400mL 5mol/L KClO3溶液 D、250mL 2mol/L AlCl3溶液
0.5mol Na2SO4中所含的Na+离子数为( )
A.3.01×1023 B.6.02×1023 C.0.5 D.1



