高三化学下学期下册试题
利用Cu和浓硫酸制备SO2的反应涉及的装置,下列说法正确的是

A.用装置①制备SO2 B.用装置②检验和收集SO2
C.用装置③稀释反应后溶液 D.用装置④测定反应后溶液中c(H+)
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。
(1)A在周期表位置________写出一种工业制备单质F的离子方程式:___________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为_______其水溶液与F单质反应的化学方程式为__________________________________.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;
c的电子式为________, d是________晶体
(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为__________mol。
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol·L-1 盐酸中含有的氯化氢分子数为NA
B.标准状况下,22.4L的SO2气体中含有的氧原子数为2NA
C.1L1.0 mol·L-1CH3COOH溶液中含有的H+数一定为NA
D.2.7g Al在与足量盐酸反应中失电子数为0.3NA
已知:(HF)2(g) ![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当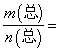 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
亚硝酰硫酸![]() 主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。

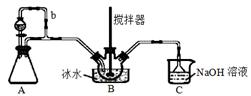
(1)装置A制取SO2,则A中反应的化学方程式为 , 导管b的作用是 。
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。反应进行到10min后,反应速度明显加快,其可能的原因是_________________。
(3)装置C的主要作用是____________。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是____________________。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L一1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4一+5C2O42一+16H+=2Mn2++10CO2↑+8H2O
达到滴定终点时的现象为__________,亚硝酰硫酸的纯度为_________。
鉴别苯酚溶液、己烷、己烯、乙醛溶液和乙醇液体,可选用的最佳试剂是
A.石蕊试液、溴水
B.溴水、新制的Cu(OH)2
C.FeCl3溶液、金属钠、溴水、石蕊试液
D.KMnO4酸性溶液、石蕊试液
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)⇌xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
![]()
![]()
A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C.若x<3,C的平衡浓度关系为:c(M)>c(N)
D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀或气体的物质的量。下列反应对应的曲线错误的是( )
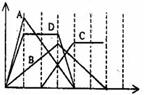
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向Na2CO3溶液中滴入盐酸至过量
D.向含有等物质的量的KOH、Ba(OH)2的混合溶液中通入CO2至沉淀消失
某有机物X加氢反应后的还原产物是CH3CH(CH3)CH2OH,关于X的下列说法正确的是
A.X可能是乙醛的同系物 B.X可能是正丁醇的同分异构体
C.X可能是乙烯的同分异构体 D.X分子中可能有碳碳双键
已知某温度下氢氰酸(HCN)的电离平衡常数是6.4×10-10(mol/L)2。请计算:
(1)常温下,1 mol/L的氢氰酸溶液中H+浓度及PH。
(2)在该酸溶液中由水电离产生的氢氧根离子的浓度。
下列离子在稳定人体血液的pH中起作用的是( )
A.Fe2+ B. Na+ C. HCO3- D. Cl-
为了探究乙醇和金属钠反应的原理,做了如下四个实验:
实验一:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体。
实验二:设法检验实验一收集到的气体。
实验三:向试管中加入3 mL水,并加入一小块金属钠,观察现象。
实验四:向试管中加入3 mL乙醚(CH3CH2OCH2CH3),并加入一小块金属钠,发现无任何现象发生。
回答以下问题:
(1)简述实验二中检验气体的实验方法及作出判断的依据:
_____________________________________________________。
(2)从结构上分析,该实验选取水和乙醚做参照物的原因是
_____________________________________________________。
(3)实验三的目的是欲证明__________;实验四的目的是欲证明____________;根据实验三和实验四的结果,可以证明乙醇和金属钠反应的化学方程式应为________________________。
利用异戊二烯合成异戊烯醇和香料乙位紫罗兰酮的流程如下图所示(部分反应条件和产物已略去):

已知:![]()
回答下列问题:
(1) 利用系统命名法对异戊二烯命名___________________________________。
(2) 写出异戊烯醇的结构简式___________________________________。
(3) E 中官能团的名称为___________________________________。
(4) 由B→G的反应类型为_______________________________;由B→C 的反应类型为_________________。(5) 有关有机物D的说法中正确的是______________。
a.存在顺反异构 b.化学式为C10H16O
c.能被银氨溶液和酸性高锰酸钾溶液氧化 d.能被氢气还原
(6) H的同分异构体有多种,则属于醛和酮的异构体共有______种(不考虑立体异构),核磁共振氢谱有两组峰,且峰的面积之比等于2:3的同分异构体的结构简式为_________________________________。
(7) 以乙醛为初始原料设计制备![]() 的合成路线_______________________________________________。
的合成路线_______________________________________________。
用含4 mol HCl的浓盐酸与足量的MnO2共热,生成的氯气为( )
A.2 mol B.1 mol C.小于1 mol D.小于2 mol,大于1 mol
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程如下:
NH3+CO2+H2O === NH4HCO3;NH4HCO3+NaCl === NaHCO3↓+NH4Cl;
2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,请写出工业合成氨的化学反应方程式 ;已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
请回答:
①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。

第二位同学:用图中戊装置进行实验(其它装置未画出)。
①为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
②装置c中的试剂为 (选填字母)。
e.碱石灰 f.浓硫酸 g.无水氯化钙
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述): 。
下列图示的实验操作,不能实现相应实验目的的是( )
|
A.研究不同催化剂对双氧水分解速率的影响 |
B.实验室演示铝热反应 |
|
C.比较碳酸钠与碳酸氢钠的热稳定性 |
D.验证铁与水燕气反应的气体产物H2 |
某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。下列说法正确的是( )
| X | Y | W | |
| n(起始状态)/mol | 2 | 1 | 0 |
| n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.升高温度,若W的体积分数减小,则此反应ΔH>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是
K=![]()
某有机反应中间体(M)的一种合成路线如图所示.


已知:①R﹣Br![]()
![]() PMgBr
PMgBr![]()
![]() RCOOH
RCOOH
②
 (R′表示氢原子或烃基)
(R′表示氢原子或烃基)
③标准状况下,气态烃A的密度是H2的14倍
④芳香族化合物H能发生银镜反应
请回答:
(1)B的名称(系统命名)为 ;H→I的反应类型为 .
(2)E中官能团的结构简式为 ,
( 3)F→G的化学方程式为 .
(4 )D+J→M的化学方程式为 .
(5)写出符合下列条件的J的所有同分异构体的结构简式 、
 (不考虑立体异构).
(不考虑立体异构).
①苯环上连有﹣NO2 ②核磁共振氢谱有3个峰
(6)结合已有知识和相关信息,写出以CH3CHO和E为原料,经三步制备
 的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO
的合成路线流程图(无机试剂任用)合成路线流程图示例为:CH3CHO![]()
![]() CH3COOH
CH3COOH![]()
![]() CH3COOCH3.
CH3COOCH3.
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这种两种物质的方法正确的是
A.分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打
B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打
C.用两只小玻璃杯,分别加入少量两种样品,再加入等量食醋,产生气泡快的是小苏打
D.先将两样品配成溶液,分别加入石灰水,无白色沉淀生成的是小苏打
KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1)为尽量少引入杂质,试剂①应选用NaOH溶液,若选用H2SO4溶液,其后果是_________。
(2)易拉罐溶解过程中主要反应的化学方程式为_______________;滤液A中的某种离子与NH4+,HCO3-均能反应生成沉淀B,该离子与NH4+反应的离子方程式为___________。
(3)Al(OH)3在水中存在两种电离方式,其中:Al(OH)3(aq)![]() AlO2-+H+(aq)+H2O(l) Ka=2.0×10-13(25℃),则25℃时Al(OH)3与NaOH溶液反应的平衡常数K=________________(列出含Kw、Ka的表达式并计算)
AlO2-+H+(aq)+H2O(l) Ka=2.0×10-13(25℃),则25℃时Al(OH)3与NaOH溶液反应的平衡常数K=________________(列出含Kw、Ka的表达式并计算)
(4)明矾与硫磺焙烧时发生反应的化学方程式为:KAl(SO4)2·12H2O+S![]() K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为____________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。
K2SO4+Al2O3+SO2↑+H2O(未配平),配平后的化学计量数依次为____________;每生成67.2L标准状况下的SO2,转移电子的物质的量为________;焙烧产生的SO2经催化氧化、吸收等过程可制得硫酸,若SO2催化氧化时的转化率为96.0%,则理论上用该法生成硫酸时硫元素的总转化率为__________。







