高三化学上学期上册试题
2−(4−甲基苯基)−1,3−丙二醇是液晶材料的重要中间体,可以用对甲基苯乙酮为原料来合成,其合成路线流程图如下:
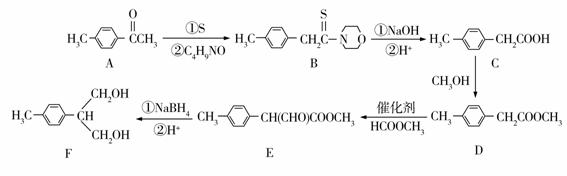
(1)E中的含氧官能团名称为 和 。
(2)实现反应C→D的方程式为 。
(3)写出一种同时满足下列条件的D的同分异构体的结构简式: 。
①含有苯环,且遇FeCl3溶液显色;
②能发生银镜反应,分子中只有5种不同化学环境的氢。
(4)A→B反应(另一种产物为水)中加入了分子式为C4H9NO的环状物质,写出其结构简式: 。
(5)乙酰乙酸乙酯(CH3COCH2COOCH2CH3 )是一种重要的有机合成原料,根据已有知识并结合相关信息,写出由乙烯制备乙酰乙酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH。
CH3CH2OH。
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应是放热反应
B.该反应氧化剂与还原剂物质的量之比为6∶5
C.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时先向A中加入铁屑,B中加入较浓的NaOH溶液,打开活塞E,再从分液漏斗中加入少量6 mo1·L-1 H2SO4溶液,等一段时间后,继续加硫酸浸没F导管的下端:

(1)A中反应的离子方程式为 。
(2)实验开始时加入少量6 mo1· L-1硫酸并等待一段时间的目的是 、
。
(3)关闭E,在A装置中可观察到的现象是 。在B装置中观察到的现象是 。
(4)C装置的作用是 。
(5)拔去装置B中的橡皮塞使空气进入,写出有关的化学方程式 。
已知A、B、C、D之间的转化关系如图所示.下列说法正确的是( )
![]()
![]()
A.若A为Fe,D为氢气,则B一定为酸
B.若A、D为化合物,B为水,则C一定是气体单质
C.若A、B、C、D均为化合物,该反应一定属于复分解反应
D.若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
H+浓度均为0.01mol/L的盐酸和醋酸各100mL分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是 ( )
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率小
D.盐酸和醋酸分别与锌反应的速率一样大
下列各分子中,所有原子都满足最外层8电子结构的是
A. BF3 B. NCl3 C. H2O D. PCl5
某单烯烃与氢气的加成产物为:CH3CH2CH(CH3)CH2CH3 ,下列相关说法正确的是
A. 该产物的名称是2-乙基丁烷
B. 该产物有3种沸点不同的一氯代物
C. 原单烯烃只可能有3种不同结构
D. 原单烯烃与分子式为C5H10的烃一定互为同系物
100 mL含有0.20 mol·L-1碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 0.1mol·L-1 B. 0.16 mol·L-1 C. 0.24 mol·L-1 D. 0.2mol·L-1
下列说法正确的是
A.中和热测定实验中需要的玻璃仪器有:烧杯、量筒、温度计、环形玻璃搅拌棒
B.乙烯的燃烧热为1411.3 kJ·mol−1,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)![]()
2CO2(g)+2H2O(g) ΔH=−1411.3 kJ·mol−1
C.用石墨电极电解1 L 0.1 mol·L−1 CuSO4溶液,若反应产生0.1 mol O2,则向原溶液中加入0.2 mol CuO能恢复至原浓度
D.用pH试纸分别测定氯水和盐酸的pH,比较两溶液的酸性强弱
能用![]() 来表示的化学反应是 ( )
来表示的化学反应是 ( )
A.氢氧化铁和稀盐酸反应
B.氨水和稀硫酸反应
C.氢氧化钠溶液和稀硝酸反应
D.二氧化碳通入澄清石灰水
25 ℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是( )
A.对于该溶液一定存在:pH≥7
B.在c(OH-)>c(H+)的溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
C.若溶液中c(A-)=c(Na+),则溶液一定呈中性
D.若溶质为NaA,则溶液中一定存在: c(Na+)>c(A-)>c(OH-)>c(H+)
氧化镁应用广泛.以菱镁矿(主要成分为MgCO3,SiO2和FeCO3)为原料制备高纯氧化镁的实验流程如下:
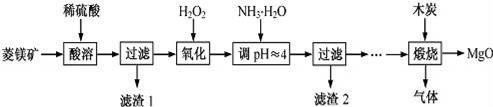
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2时,反应的离子方程式为 .
(3)滤渣1和滤渣2的成分别是 (填化学式) .
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
①上述煅烧过程中产生的SO2用溴水吸收,离子方程式为
②得到的淡黄色固体S与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式 .
硝酸与金属反应时,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
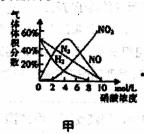
查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示:
b.NO2沸点:21℃;NO沸点:-151℃
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
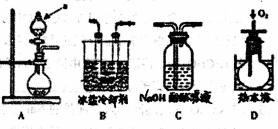
(1)第一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(2)从第一个C装置中逸出的气体成分是________。
(3)溶液中还可能有一种还旅产物,这种还原产物可能是 ,请设计实验验证你的猜想 ;并写出生成该还原产物的化学方程式
铁及其化合物在日常生活中应用广泛。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24 L(标准状况),最主要的原因是____________________________;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:________________________________。
(2)氧化铁是重要的工业颜料,下面是制备氧化铁的一种方法(铁屑表面常附着油污),其流程如下:
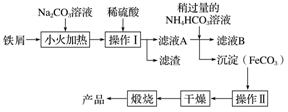
①操作Ⅰ的名称是________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________________。
②滤液A中加入稍过量的NH4HCO3溶液,生成沉淀的同时有一种气体(能使澄清石灰水变浑浊)产生,写出其化学方程式: __________________________________。
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,加酸溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,重复滴定2~3次,消耗酸性KMnO4溶液体积的平均值为20.00 mL。
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是________(填序号)。
a.硝酸 b.盐酸 c.硫酸
②上述产品中Fe2O3的质量分数为________。
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
A.原子半径的大小顺序: r(Y)>r(Z)>r(W) B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g • cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol • L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A.该浓硝酸中的HNO3的物质的量浓度是14.0 mol • L-1
B.加入NaOH溶液的体积是50 mL
C.浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D.得到的金属氢氧化物的沉淀为3.12 g
.向物质的量浓度均为1mol/L的Fe2(SO4)3、CuSO4的1L混合液中加入a mol铁粉,充分反应后,下列说法正确的是 ( )
A. 当a≤1时,发生的反![]() 应为Fe+Cu2+=Fe2++Cu
应为Fe+Cu2+=Fe2++Cu
B. 当固体有剩余时,溶液中一定存在Fe2+、Cu2+
C. 当1≤a<2时,溶液中 n(Fe2+)=(2+a)mol
D. 若有固体剩余,则固体中一定有铁,可能有铜
同温同压下,对于等体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体,下列说法正确的是: ( )
A.含相同的分子数和原子数 B.含相同的分子数和电子数
C.含相同的质子数和中子数 D.所含分子数和质量均不相同
.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,
Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐
溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确
的是
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中不正确的是( )
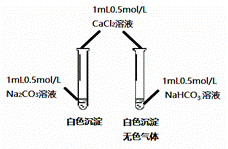
A.实验前pH(Na2CO3)>pH(NaHCO3)
B.实验后两溶液中离子种类完全相同
C.Na2CO3溶液中生成的沉淀比NaHCO3溶液中生成的沉淀多
D.两溶液中反应的基本类型相同



