2017-2018年高一上半年期中考化学免费试卷完整版(上海复旦附中)
| 1. 选择题 | 详细信息 |
|
1993年8月,我国科学家利用超高扫描隧道显微镜,在一块晶体硅的表面通过探针的作用搬走原子,写下了“中国”两个字。下列说法中,错误的是( ) A.上述操作中发生了化学变化 B.这两个汉字是当时世界上最小的汉字 C.上述操作中发生了物理变化 D.这标志着我国科学已经进入了可操纵原子的阶段 |
|
| 2. 选择题 | 详细信息 |
|
下列说法中正确的是 A. 人们已知道了107 种元素,即已经知道了107 种原子 B. 互为同位素的原子,它们原子核内的中子数一定不相等 C. 40K 和 40Ca 原子核内的中子数相等 D. 质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同 |
|
| 3. 选择题 | 详细信息 |
|
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( ) A.硫离子的电子式: B.  C.质量数为3的超重氢原子: D.次氯酸钙的化学式: |
|
| 4. 选择题 | 详细信息 |
|
下列物质中质量最大的是( ) A.1mol硫酸 B.22.4L(S.T.P)水 C.44.8(S.T.P)O2 D. |
|
| 5. 选择题 | 详细信息 |
|
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。同温下将等质量的氢气与氦气同时充入容器,符合实际情况的是( ) A. 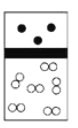 B. B.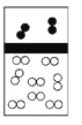 C. C.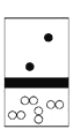 D. D.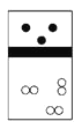 |
|
| 6. 选择题 | 详细信息 |
|
A.常温下11.2升的甲烷气体含有甲烷分子数为 B. C.40克硝酸铵中含有的氮原子数为 D.在铁与氯气的反应中, |
|
| 7. 选择题 | 详细信息 |
|
下列离子方程式书写错误的是( ) A.三氧化硫与水反应: B.碳酸钙与盐酸: C.氧化铜与稀硫酸: D.碳酸氢钠溶液与氢氧化钡溶液反应: |
|
| 8. 选择题 | 详细信息 |
|
某粒子用 A.所含的质子数= C.所含的电子数= |
|
| 9. 选择题 | 详细信息 |
|
在提纯粗盐时,为了除去 A. C. |
|
| 10. 选择题 | 详细信息 |
|
对于反应: A. C.有 |
|
| 11. 选择题 | 详细信息 |
|
下列反应中, A. B. C. D. |
|
| 12. 选择题 | 详细信息 |
|
下列关于氯化氢的叙述中,不正确的是( ) A.氯化氢极易溶于水,能进行喷泉实验 B.液态氯化氢不能导电 C.氯化氢在空气中扩散时能形成白烟 D.氯化氢能使湿润的蓝色石蕊试纸变红 |
|
| 13. 选择题 | 详细信息 |
|
将一瓶新制的氯水长期放置后,溶液中离子或分子不会减少的是( ) A. |
|
| 14. 选择题 | 详细信息 |
如图所示,广口瓶中盛有某气体A,胶头滴管中盛有某液体B,将液体B滴入气体A后,气球迅速变大。不符合这一现象的是( )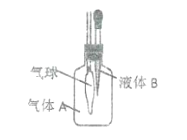 A.A是 B.A是 C.A是 D.A是 |
|
| 15. 选择题 | 详细信息 |
|
有一真空储气瓶净重为500克,在相同条件下,充满氧气后质量为508克,当充满另一种气体X时质量为512克,则X的分子量为( ) A.16 B.44 C.48 D.64 |
|
| 16. 选择题 | 详细信息 |
某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气发生反应。下列叙述中错误的是( )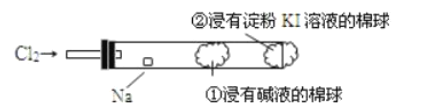 A.钠着火剧烈燃烧产生苍白色的火焰 B.反应产生的大量白烟是氯化钠固体 C.棉球①的作用是吸收过量氯气防止污染 D.棉球②变蓝色则证明氯气未被碱液完全吸收 |
|
| 17. 选择题 | 详细信息 |
|
相同体积的硫酸钠、硫酸镁、硫酸铁溶液分别加入足量的氯化钡溶液,产生相同质量的沉淀,则三种溶液的物质的量浓度之比为( ) A.1:1:3 B.1:2:3 C.3:3:1 D.6:3:2 |
|
| 18. 选择题 | 详细信息 |
|
M(NO3)2热分解化学方程式为2M(NO3)2 A.64g/mol B.24g/mol C.65g/mol D.40g/mol |
|
| 19. 选择题 | 详细信息 |
|
已知反应:3Cl2+NH3→6NH4Cl+N2,下列分析正确的是(设阿伏伽德罗常数为NA) A. 若3molCl2反应,得到氧化产物6mol B. 若常温下生成22.4LN2,转移电子数6NA C. 若转移6mol电子,被氧化的NH3是8mol D. 若生成1 molNH4Cl转移电子n个,则NA=n |
|
| 20. 选择题 | 详细信息 |
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )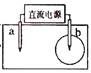 A. b电极是阴极 B. a电极与电源的正极相连 C. 电解过程中水是氧化剂 D. b电极附近溶液的pH变小 |
|
| 21. 选择题 | 详细信息 |
|
在 A. |
|
| 22. 选择题 | 详细信息 |
|
将a mol H2、Cl2混合气体(体积比为1:2)经光照充分反应后,所得气体恰好使溶液中 b mol NaOH 完全转变为盐,则a、b 的关系为( ) A.a=b B.2a=b C.4a=3b D.2a=3b |
|
| 23. 选择题 | 详细信息 |
|
新型纳米材料 A. C. |
|
| 24. 填空题 | 详细信息 | ||||||||||
现有部分短周期(即原子序数为1~18号)元素的性质或原子结构如下表:
|
|||||||||||
| 25. 填空题 | 详细信息 |
|
|
|
| 26. 填空题 | 详细信息 |
|
已知某混合气体的成分按体积分数计算是: 该混合气体的平均式量为_________,该混合气体在标准状况下对氢气的密度是____________。 |
|
| 27. 填空题 | 详细信息 |
|
同温同压下,同体积的氨气( |
|
| 28. 计算题 | 详细信息 |
|
混合气体由 |
|
| 29. 填空题 | 详细信息 |
|
标出下列氧化还原反应中电子转移的方向和数目____________ 该反应的还原产物是______________;____________元素被氧化;若反应有 |
|
| 30. | 详细信息 |
1929年,吴蕴初先生在上海创建了天原化工厂,它是中国最早的氯碱工业。下图给出了部分生产流程: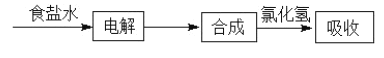 (1)阳极产生气体使_____________(试纸)变蓝,检验的离子方程式为___________。 (2)将电解饱和食盐水得到的气体通入合成塔中合成氯化氢,其中需要过量的气体是__________,在合成塔中燃烧时火焰呈_______色。 (3)实验室里可用氯化钠固体和浓硫酸在微热条件下反应制取氯化氢,化学方程式是________。 (4)工业上利用电解饱和食盐水可制得重要化工产品。将制得的氯气通入石灰乳中可以制得漂粉精,写出反应的化学方程式______,漂粉精可用于游泳池中水的消毒,原因是(用化学方程式表示):______。 (5)实验室里可以用次氯酸钙固体与过量的浓盐酸在常温下快速制取氯气,反应的化学方程式是____。 |
|
| 31. 计算题 | 详细信息 |
|
在标准状态下,300体积的氯化氢溶解在1体积的水中,形成密度为 |
|
| 32. 实验题 | 详细信息 |
实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。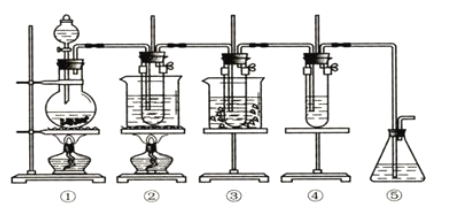 图中①为氯气发生装置,②的试管中盛有 (1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过_________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。 (2)为除去氯气中混有的氯化氢气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。 a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液 (3)本实验制取次氯酸钠的离子方程式是____________________。 (4)比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是__。 (5)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________(填写实验操作名称)。 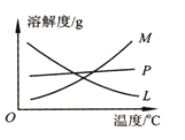 (6)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为_________,随后溶液逐渐变为无色,是因为___________________。 |
|
| 33. 计算题 | 详细信息 |
|
某盐酸的密度为 (1)该盐酸的物质的量浓度是多少?(小数点后保留两位)_________ (2)在足量的该盐酸溶液中,加入镁粉和铝粉混合物 |
|
| 34. 计算题 | 详细信息 |
|
在 (1)试确定原混合气体中 (2)若反应后的气体密度与在相同条件下的 |
|
最近更新



