山西高一化学月考测验(2018年下半期)在线做题
| 1. 选择题 | 详细信息 |
|
美国研究人员将 CO 和氧原子附着在一种铁催化剂表面,用激光脉冲将其加热到 2000K,成功观察到CO 与氧原子形成化学键生成CO2的全过程。下列说法正确的是( ) A. CO、CO2均属于酸性氧化物 B. O2断键形成氧原子时需放出能量 C. CO 与氧原子形成化学键生成CO2 需要吸收能量 D. CO 与氧原子形成化学键过程中有电子转移 |
|
| 2. 选择题 | 详细信息 |
如图所示,有关化学反应和能量变化的说法正确的是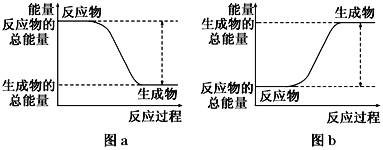 A. 图a表示的是吸热反应的能量变化 B. 图b中反应物比生成物稳定 C. 图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化 D. 图a不需要加热就一定能发生,图b一定需要加热才能发生 |
|
| 3. 选择题 | 详细信息 |
|
根据热化学方程式S(l)+O2(g)═SO2(g)△H=﹣293.23kJ·mol﹣1,分析下列说法中正确的是( ) A.1mol固体S单质燃烧放出的热量大于293.23 kJ B.1mol气体S单质燃烧放出的热量小于293.23 kJ C.1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 D.1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
|
| 4. 选择题 | 详细信息 |
短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )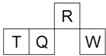 A. 最简单气态氢化物的热稳定性:R>Q B. 最高价氧化物对应水化物的酸性:Q<W C. 原子半径:T>Q>R D. 含 T 的盐溶液一定能电离出 T 的阳离子 |
|
| 5. 选择题 | 详细信息 |
|
已知33As、35Br位于同一周期,下列关系正确的是 A. 原子半径:As>C1>P B. 热稳定性:HC1>AsH3>HBr C. 还原性:As3->S2->C1- D. 酸性:H3AsO4>H2SO4>H3PO4 |
|
| 6. 选择题 | 详细信息 |
|
下列关于原子结构、元素性质的说法正确的是( ) A. 非金属元素组成的化合物中只含共价键 B. ⅠA 族金属元素是同周期中金属性最强的元素 C. 质子数相同中子数不同的微粒互称同位素 D. ⅦA 族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
|
| 7. 选择题 | 详细信息 |
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是 A. 原子半径:Z>Y>X B. 气态氢化物的热稳定性:W>R C. WX3和水反应形成的化合物是离子化合物 D. Y和Z两者最高价氧化物对应的水化物之间能相互反应 |
|
| 8. 选择题 | 详细信息 |
|
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是 A. X、Y、Z、W的原子半径依次减小 B. W与X形成的化合物中只含离子键 C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
|
| 9. 选择题 | 详细信息 |
|
X、Y、Z、M、W 为五种短周期元素。X、Y、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为 15,X 与 Z 可形成XZ2分子;Y 与 M 形成的气态化合物在标准状况下的密度为 0.76g/L;W 的 质子数是 X、Y、Z、M 四种元素质子数之和的 1/2。下列说法正确的是( ) A. 原子半径:W>Z>Y>X>M B. XZ2、XM4、W2Z2均为共价化合物 C. 由 X 元素形成的单质只有两种 D. 由 X、Y、Z、M 四种元素形成的化合物可能既含离子键,又含共价键 |
|
| 10. 选择题 | 详细信息 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )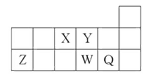 A. 元素X与元素Z的最高正化合价之和的数值等于8 B. 原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q) C. 离子Y2-和Z3+的核外电子数和电子层数都不相同 D. 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
|
| 11. 选择题 | 详细信息 |
|
依据元素周期表示元素周期律,下列推断正确的是 A. H3BO3的酸性比H2CO3的强 B. Mg(OH)2的碱性比Be(OH)2的强 C. HCl HBr HI的热稳定性依次增强 D. 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
|
| 12. 选择题 | 详细信息 |
|
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第 VA 族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( ) A. 原子半径:丁>丙>乙 B. 单质的还原性:丁>丙>甲 C. 甲、乙、丙的氧化物均为共价化合物 D. 乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
|
| 13. 选择题 | 详细信息 |
|
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是 A. 元素原子的最外层电子数等于元素的最高化合价 B. 多电子原子中,在离核较近的区域内运动的电子能量较高 C. P,S,Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 D. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
|
| 14. 选择题 | 详细信息 |
|
短周期元素 W、X、Y 和 Z 的原子序数依次增大。元素 W 是制备一种高效电池的重要材料,X 原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地壳中含量最丰富的金属元素,Z 原子的最外层电子数是其电子层数的 2 倍。下列说法错误的是( ) A. 元素 W、X 的氯化物中,各原子均满足 8 电子的稳定结构 B. 元素 X 与氢形成的化合物有很多种 C. 元素 Y 的单质与氢氧化钠溶液或盐酸反应均有氢气生成 D. 元素 Z 可与元素 X 形成共价化合物XZ2 |
|
| 15. 选择题 | 详细信息 |
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( ) A. 原子半径:丙<丁<戊 B. 金属性:甲>丙 C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙 |
|
| 16. 选择题 | 详细信息 | |||||||||||||||
几种短周期元素的原子半径及主要化合价如下表:
|
||||||||||||||||
| 17. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 形成离子键的阴阳离子间只存在静电吸引力 B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 C. 第三周期非金属元素含氧酸的酸性从左到右依次增强 D. 元素周期律是元素原子核外电子排布周期性变化的结果 |
|
| 18. 选择题 | 详细信息 |
|
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素 B 的原子最外层电子数是其电子层数的 2 倍,元素 C 在同周期的主族元素中原子半径最大,元素 D 的合金是日常生活中常用的金属材料。下列说法正确的是( ) A. 元素 A、B 组成的化合物常温下一定呈气态 B. 元素 C、D 的最高价氧化物对应的水化物易溶于水 C. BE4是常见的有机溶剂 D. 化合物 AE 与 CE 有相同类型的化学 |
|
| 19. 实验题 | 详细信息 |
如图是某同学设计的放热反应的观察装置。其实验操作步骤如下: ① 按图所示将实验装置连接好; ② 在 U 形管内加入少量红墨水(或品红溶液),打开 T 形管活塞,使 U 形管内两边的液面处于同一水平 面,再关闭 T 形管活塞; ③ 在盛有 1.0g 氧化钙的小试管里滴入 2mL 左右的蒸馏水,观察现象。 试回答: (1)实验前必须进行的一步实验操作是_____。 (2)实验中观察到的现象是_____。 (3)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系:_________。 (4)若该实验中 CaO 换成 NaCl,实验还能否观察到相同现象?_____(填“能” 或“否”)。 |
|
| 20. 推断题 | 详细信息 |
A、B、C、D、E、F六种物质的转化关系如图所示。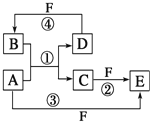 (1)若 A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数 A 是 D 的 2 倍,所含元素的原子最外层电子数 D 是 A 的 2 倍,F 的浓溶液与 A、D 反应都有红棕色气体生成。请写出以下物 质的化学式:B_____F_____;反应④的化学方程式为_____. (2)若 A 是常见的变价金属的单质,D、F 是气态单质,且反应①在水溶液中进行。反应②也在水溶液 中进行,其离子方程式是_____。 |
|
| 21. 填空题 | 详细信息 | |||||||||||||||
X、Y、Z、W 四种常见元素,其中 X、Y、Z 为短周期元素。有关信息如下:
|
||||||||||||||||
| 22. 填空题 | 详细信息 |
四种短周期元素 W、X、Y、Z,原子序数依次增大,请回答下列问题。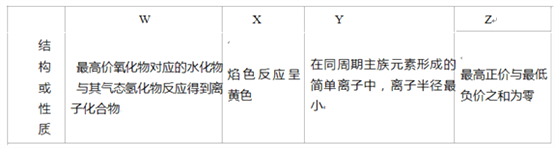 (1)Z 在元素周期表中位于_____族。 (2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学 反应,该元素是_____(填元素符号). (3)① 下列可作为比较 X 和 Y 金属性强弱的依据是_____(填序号). a.自然界中的含量 b.单质与酸反应时失去的电子数 c.单质与水反应的难易程度 d.最高价氧化物对应水化物的碱性 ② 从原子结构的角度解释 X 的金属性强于 Y 的原因:_____,原子半径 X>Y,所以原子核 对最外层电子的吸引力 X失电子能力 X>Y. (4)W 的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与 X 的最高 价氧化物对应的水化物混合,反应的化学方程式是_____。 (5)Y 单质和 Mg 组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。  能确定混合物中 Y 的质量分数的数据有_____(填序号). a. m、n b. m、y c. n、y |
|
| 23. 推断题 | 详细信息 |
|
A、B、C、D、E 五种短周期元素(A、B、C、D、E 分别代表元素符号),它们的原子序数依次增大; A 是元素周期表中原子半径最小的元素;B 元素最高价氧化物对应的水化物与其氢化物反应生成一种盐 X;D 与 A 同主族,且与 E 同周期;E 元素原子的最外层电子数是其次外层电子数的 3/4 倍;C 与 E 同 主族。请回答下列问题: (1)X 的化学式_____。 (2)下列各项中,能说明元素 C 比 E 非金属性强的事实有_____(填序号). ① 氢化物H2E的酸性比H2C强 ② 氢化物H2C的热稳定性比H2E强 ③ 氢化物H2E的水溶液放置在空气中会变浑浊 ④ C 与 E 组成化合物,C 显负价 (3)将由 BC 和BC2组成的混合气体通入如图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。  已知(i)浓硝酸能将气体 BC 氧化成BC2,而稀硝酸不能氧化 BC。 (ii)NaOH 溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC+H2O,NaOH溶液与 BC 气体不反应。 装置②、③中盛放的药品依次是_______、______________. (4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是__________(填 一种气体的化学式)。 |
|
| 24. 推断题 | 详细信息 |
| X、Y、Z 为原子序数 1~20 号内的元素,将 4.7g X 的最高价氧化物X2O溶于 95.3g 水中,所 得溶液浓度为 5.6% 。Y 元素原子与 X 元素原子的最外电子层电子数相同,12g Y 的氢氧化物恰好被0.75 mol/L 的盐酸 400mL 所中和。Z、Y 的原子核外电子层数相同,16g ZO2气体在标准状况下的体积 为 5.6L。试求 X、Y、Z 元素名称。X______________,Y_______________,Z____________ | |
- 2017-2018年高二上半年第二次月考化学考题带答案和解析(福建省莆田九中)
- 2018届高三上学期第五次月考理科综合-化学试卷(江西省南昌市第二中学)
- 2017-2018年高一上学期第二次阶段性检测化学考题带答案和解析(湖南省长沙市第一中学)
- 2017-2018年高一上学期第二次月考化学考题带答案和解析(河南省商丘市第一高级中学)
- 2017届高一上第三次月考化学试卷(安徽省淮北一中)
- 高中化学人教版 选修三 第3章 晶体结构与性质 金属晶体的原子堆积模型
- 2017-2018年高二12月月考化学考卷带参考答案和解析(安徽省铜陵市第一中学)
- 2017,2018年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用



