2019届初三下半期中考二模化学题带答案和解析(湖北省襄阳市枣阳市吉河中学)
| 1. | 详细信息 |
中华民族的发明创造为人类文明进步作出了巨大贡献。下列古代发明及应用中,不涉及化学变化的是( )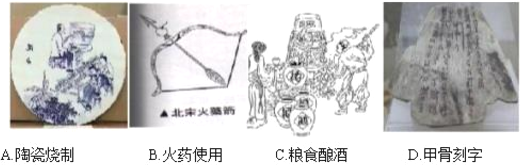 A. A B. B C. C D. D |
|
| 2. | 详细信息 |
|
下列各组物质中,前者属于纯净物,后者属于混合物的是( ) A. 洁净的空气 氮气 B. 稀有气体 人体呼出气体 C. 二氧化碳 冰水混合物 D. 蒸馏水 海水 |
|
| 3. | 详细信息 |
|
下列反应中不属于化合、分解、置换反应的是( ) A. Fe+2HCl═FeCl2+H2↑ B. 2NO+O2=2NO2 C. 3CO+Fe2O3 D. 2NaCl |
|
| 4. | 详细信息 | ||||||||||||
下表是生活中一些物质的pH,有关它们的说法中错误的是( )
|
|||||||||||||
| 5. | 详细信息 |
|
下列括号中的物质是某同学除去杂质所用的试剂,其中合理的是( ) A. NaCl中混有少量的Na2CO3[HNO3] B. CO2中混有少量CO[Ca(OH)2] C. KNO3中混有少量的CuSO4[Ba(OH)2] D. Fe粉中混有少量的CuO[HCl] |
|
| 6. | 详细信息 | ||||||||
下列图象能正确反映对应变化关系的是( )
|
|||||||||
| 7. | 详细信息 |
|
决定元素化学性质的是原子的 A.电子数 B.中子数 C.质子数 D.最外层电子数 |
|
| 8. | 详细信息 |
|
一瓶密封保存的KNO3饱和溶液,当温度改变时,下列说法中,正确的是( ) A. 不管升温还是降温,溶液成分都保持不变 B. 温度升高,则变成不饱和溶液,溶质质量分数不变 C. 温度降低,仍为饱和溶液,溶质质量分数不变 D. 温度升高,溶液的溶质质量分数变小 |
|
| 9. | 详细信息 |
|
下列说法不正确的是( ) A. 塑料是最常见的有机合成材料,具有密度小、耐腐蚀、易加工等优点 B. NaOH 溶液可以除去热水瓶胆内壁的水垢[Mg(OH)2与 CaCO3的混合物] C. 骨质疏松、佝偻病患者可在医生指导下服用钙片治疗 D. 新装修的房间内,常用炭包(装有活性炭)来除去甲醛等有害气体 |
|
| 10. | 详细信息 |
|
某同学到了傍晚时就看不见东西,患了夜盲症,他体内缺少的维生素可能是( ) A. 维生素A B. 维生素B C. 维生素C D. 维生素D |
|
| 11. | 详细信息 |
|
生产、生活中处处有化学,现有:氦气、氮气、氢气、二氧化硫、二氧化碳、一氧化碳,请按要求用上述物质的化学式回答: ①常用作灭火剂的物质是________(填化学式)。 ②能作有色光源的物质是________(填化学式)。 ③会引起酸雨的物质是_______(填化学式)。 ④能作为清洁能源的物质是_______(填化学式)。 ⑤能跟血液里的血红蛋白结合而使人中毒的物质是______(填化学式)。 |
|
| 12. | 详细信息 |
如图是 a、b、c 三种固体物质的溶解度曲线,下列说法正确的是_____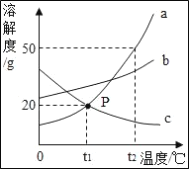 A t1℃时 a、c 的溶解度相等 B 使 t1℃时 a、b 的饱和溶液升温至 t2℃仍为饱和溶 液,需加入的 a 比 b 多 C t1℃时 a、c 的溶液中溶质质量分数一定相等 D t2℃时,将 a、b、c 的饱和溶液的温度降低至 t1℃,所得溶液中溶质质量分数大小关系为_____ |
|
| 13. | 详细信息 |
某同学通过下列实验验证质量守恒定律。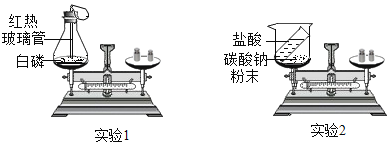 (1)2个实验方案中,合理的是__________(填“实验一”或“实验二”)。 (2)实验二中,天平的指针______(填序号),其原因是_________________。 A.向左偏转 B.不偏转 C.向右偏转 |
|
| 14. | 详细信息 |
|
用化学方程式回答下列问题: (1)盛放石灰水的试剂瓶内壁常有一层白膜的原因是____________________。 (2)收藏家收藏清朝末年的铝制品至今仍保存完好,原因是在常温下,其表面形成一层致密的氧化膜 ___________。 (3)人在剧烈运动后,血液中产生较多的乳酸(化学式为C3H603),使肌肉酸痛,放松一段时间后,由于乳酸与吸入的氧气反应而生成二氧化碳和水,使肌肉的酸痛感消失,该反应的方程式是___________。 |
|
| 15. | 详细信息 |
|
现有石灰石、生石灰、盐酸、氢氧化钠溶液、硫酸铜溶液、水、镁带,从中选取适当的物质完成下列反应的化学方程式: (1)有沉淀生成的复分解反应:______。 (2)有气体生成的置换反应:______。 (3)中和反应:______。 (4)化合反应:______。 (5)分解反应:______。 |
|
| 16. | 详细信息 |
|
选出相应的物质并将序号填写在横线上(有的可能不止一个答案). ①熟石灰 ②硫酸铜 ③稀硫酸 ④硝酸钠 ⑤磷酸铵 ⑥锌粒 ⑦稀盐酸 (1)可用来作复合肥料的是_____. (2)实验室里用来制取氢气的原料是_____. (3)用于改良酸性土壤的是_____. (4)不参加任何复分解反应的物质是_____. (5)属于波尔多液原料的是_____. (6)检验碳酸盐所需要的物质之一是_____. |
|
| 17. | 详细信息 |
|
食盐是一种重要的化工原料。请回答下列问题。 (1)下图是实验室除去粗盐中泥沙等难溶性杂质的实验步骤。 ①过滤所用的玻璃仪器有:烧杯、漏斗和 ,该仪器的作用是_________。 ②在蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。应使用_____________(填仪器名称)取下热的蒸发皿,放于石棉网上。 (2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。 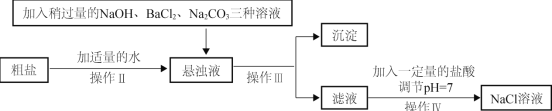 ①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是(用化学方程式表示)。 ②加入的氢氧化钠溶液要过量的目的是___________________________。 ③操作Ⅲ的名称是_________,通过操作Ⅲ所得滤液中的溶质有 (用化学式表示)。 |
|
| 18. | 详细信息 |
我市中考化学实验操作已经结束,下图是小岂同学实验的主要操作过程的示意图。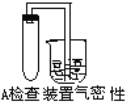 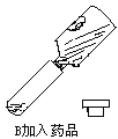 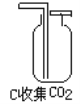 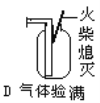  评分标准每项1分,满分5分,实验完后他得3分。请找出他失分操作是_____、_____。 |
|
| 19. | 详细信息 |
|
实验室有一包固体铜的样品粉末,其中可能混入了锌、铁中的一种或两种物质。化学兴趣小组同学对这包样品进行了如下实验。 实验1﹣﹣确定样品成分 (1)提出猜想猜想1:样品为铜、锌 猜想2:样品为铜、铁 猜想3:样品为铜、_____(填名称) (2)用磁铁靠近该样品,观察到_____(填“有”或“无”)固体被吸引,则猜想1不成立。 (3)要继续证明该样品成分,另取样品少许于试管中,应加入的药品为_____(填序号)。 A.硝酸镁溶液 B.硝酸铝溶液 C.硝酸锌溶液 D.硝酸亚铁溶液 观察实验现象,最终确定该样品为铜、铁混合物。 实验2﹣﹣样品性质探究:将该样品与过量的硝酸银溶液混合。经实验测定、溶液质量随反应时间变化的情况如图所示。下列说法错误的是_____(填序号)。 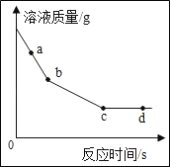 A.a点溶液中的溶质有硝酸亚铁、硝酸铜、硝酸银 B.b点金属单质有三种,溶液中的溶质有两种 C.图上bc段发生的是铜和硝酸银溶液的反应 D.c点和d点金属单质种类相同,溶液中的溶质种类相同 实验3﹣﹣测定该样品中铜的质量分数 步骤:①称取ag样品放入烧杯,滴入足量稀盐酸。 ②取一张质量为bg的滤纸,制作并安装好过滤器。 ③待①中反应充分后,过滤。 ④取滤渣连同滤纸烘干、称量,质量为cg。 回答下列问题: (1)整个实验过程中用到的玻璃仪器有烧杯、胶头滴管、_____、玻璃棒等。 (2)通过上述实验测得样品中铜的质量分数是_____(用a、b、c表示)。 (3)小明测定的数据偏大,可能的原因是_____ (填序号)。 A.过滤时,漏斗中液面高于滤纸边沿 B.③、④之间,缺少洗涤滤渣的步骤 C.称量时,将药品和砝码放反了(假定只有步骤④称量时使用了游码) D.步骤①中操作不当,所加盐酸量不足 |
|
| 20. | 详细信息 |
| 某硝酸铵样品中NH4NO3的质量分数是90%(杂质不含氮),该肥样品中氮元素的质量分数是_____。 | |
最近更新