2019年广东省湛江市高三9月调研考试化学免费试卷
| 1. 选择题 | 详细信息 |
东汉晚期的青铜奔马(马踏飞燕)充分体现了我国光辉灿烂的古代科技,已成为我国的旅游标志。下列说法错误的是 A.青铜是我国使用最早的合金、含铜、锡、铅等元素 B.青铜的机械性能优良,硬度和熔点均高于纯铜 C.铜器皿表面的铜绿可用明矾溶液清洗 D.“曾青( |
|
| 2. 选择题 | 详细信息 |
|
设 A.常温常压下,9.5 g羟基( B. C. D. |
|
| 3. 选择题 | 详细信息 |
三种有机物之间的转化关系如下,下列说法错误的是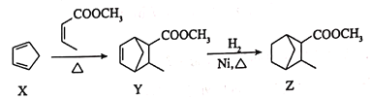 A.X中所有碳原子处于同一平面 B.Y的分子式为 C.由Y生成Z的反应类型为加成反应 D.Z的一氯代物有9种(不含立体异构) |
|
| 4. 选择题 | 详细信息 | ||||||||||||||||||||
根据下列实验操作和现象得出的结论正确的是
|
|||||||||||||||||||||
| 5. 选择题 | 详细信息 |
电化学合成氨法实现了氨的常温常压合成,一种碱性介质下的工作原理示意图如下所示。下列说法错误的是 A.b接外加电源的正极 B.交换膜为阴离子交换膜 C.左池的电极反应式为 D.右池中水发生还原反应生成氧气 |
|
| 6. 选择题 | 详细信息 |
常温下,用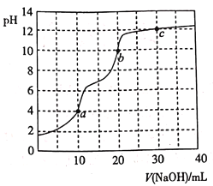 A.滴定终点a可选择甲基橙作指示剂 B.c点溶液中 C.b点溶液中 D.a、b、c三点中水的电离程度最大的是c |
|
| 7. 选择题 | 详细信息 |
某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W、X、Y三种简单离子的核外电子排布相同。下列说法错误的是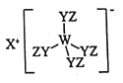 A.原子半径: B.简单离子的氧化性: C.X与Y、Y与Z均可形成具有漂白性的化合物 D.W与X的最高价氧化物的水化物可相互反应 |
|
| 8. 实验题 | 详细信息 |
实验室利用如下装置制备氯酸钾和次氯酸钠。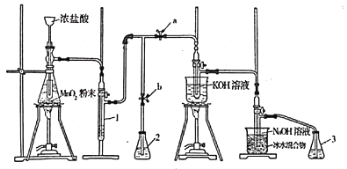 回答下列问题: (1)滴加浓盐酸的漏斗伸入试管底部,其原因为________________________________。 (2)装置1中盛放的试剂为________;若取消此装置,对实验造成的影响为________。 (3)装置中生成氯酸钾的化学方程式为________________________,产生等物质的量的氯酸钾和次氯酸钠,转移电子的物质的量之比为________。 (4)装置2和3中盛放的试剂均为________。 (5)待生成氯酸钾和次氯酸钠的反应结束后,停止加热。接下来的操作为打开________(填“a”或“b”,下同),关闭________。 |
|
| 9. | 详细信息 |
磷铁(含P、Fe、Cr等)是磷化工生产过程中产生的副产物,一种以磷铁为原料制备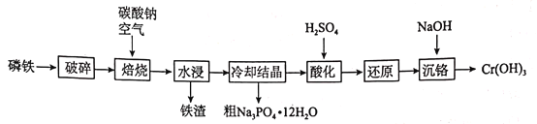 已知:水浸后溶液的主要成分为 (1)“破碎”的目的为________________________________________________________。 (2)“焙烧”时,应将原料加到________坩埚中(填“陶瓷”或“钢制”),原因是_____________(结合化学方程式解释),Cr单质发生的主要反应的化学方程式为________。 (3)进一步提纯粗磷酸钠晶体的方法为________________。 (4)“酸化”时发生反应的离子方程式为________________________________________________。 (5)“沉铬”时,加NaOH调节至pH为________时,铬离子刚好沉淀完全。(已知: |
|
| 10. 综合题 | 详细信息 | ||||||||||||||||||
|
三氯胺( (1)已知:Ⅱ. (2)向容积均为2 L的甲、乙两个恒温密闭容器中分别加入
|
|||||||||||||||||||
| 11. 综合题 | 详细信息 | |||||||||||||||||||
|
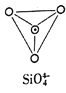
硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题: (1)基态Fe原子价层电子的电子排布图为________,基态Si原子电子占据最高能级的电子云轮廓图为________形。 (2)绿帘石的组成为 (3)
|
||||||||||||||||||||
| 12. 综合题 | 详细信息 |
扎来普隆是一种短期治疗失眠症的药物,其合成路线如下: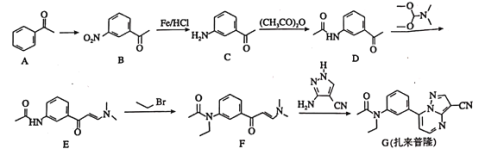 回答下列问题: (1)A中的官能团名称是________________。 (2) (3) (4)扎来普隆的分子式为________________。 (5) (6)属于芳香化合物,且含有硝基,并能发生银镜反应的B的同分异构体有________种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式有________________。 (7)已知:  和乙醇制备 和乙醇制备 的合成路线(无机试剂任选)。________ 的合成路线(无机试剂任选)。________ |
|
- 2017-2018年高二上学期第三次月考化学考卷带参考答案和解析(江西省南昌市第二中学)
- 高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 铁的重要化合物
- 黄金30题系列 高二化学 小题好拿分
- 2016-2017年高一下半期理综化学开学考试(安徽师大附中)
- 高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用
- 2017-2018年高二12月联考化学考试题(河南省豫北重点中学)
- 2016-2017年高一下半年化学开学考试专题训练(广西省桂林市第十八中学)
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时