2017-2018年高二上学期第三次月考化学考卷带参考答案和解析(江西省南昌市第二中学)
| 1. 选择题 | 详细信息 |
|
下列说法与盐类水解有关且正确的是 A. AlCl3溶液和NaAlO2溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 C. 用加热、过滤的方法可除去KCl溶液中混有的Fe3+ D. 普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸钠溶液 |
|
| 2. 选择题 | 详细信息 |
|
为了防止热带鱼池中水藻的生长,需保持水中Cu2+的浓度约1.2×10-5 mol?L-1。为避免在每次换池水时溶液浓度的改变,可把适当的含铜化合物放在池底,其饱和溶液提供适当的Cu2+。已知CuS、Cu(OH)2、CuCO3的Ksp值依次为1.3×10-36、2.2×10-20、1.4×10-10,下列四种物质中,能基本满足池水浓度要求的是 A. CuSO4 B. CuCO3 C. Cu(OH)2 D. CuS |
|
| 3. 选择题 | 详细信息 |
|
某无色溶液中加入过量的稀盐酸有沉淀生成,过滤后向滤液中加入过量的纯碱溶液又有沉淀生成,下列溶液中符合此条件的是( ) ①Ag+、Fe3+、Na+ ②Ag+、Al3+、K+ ③Ag+、Ba2+、NO3- ④SiO32-、AlO2-、K+ ⑤Ag+、NH4+、H+ ⑥AlO2-、K+、Al3+ A. ①②⑤ B. ②③④ C. ②③④⑥ D. ①②③④⑥ |
|
| 4. 选择题 | 详细信息 |
|
25 ℃时,某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是 A.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) D.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
|
| 5. 选择题 | 详细信息 |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) A. 往平衡体系中加入金属铅后,c(Pb2+)增大 B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 D. 25 ℃时,该反应的平衡常数K=2.2 |
|
| 6. 选择题 | 详细信息 | ||||||||||
相关物质的溶度积常数见下表(25℃):
|
|||||||||||
| 7. 选择题 | 详细信息 |
|
用惰性电极电解下列足量的溶液,一段时间后,再加入一定量的另一物质(括号内)后,溶液能与原来溶液浓度一样的是 A. CuCl2(CuCl2溶液) B. AgNO3(Ag2O) C. NaCl(盐酸) D. CuSO4(Cu(OH)2) |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是 A. 0.1 mol?L-1 Na2CO3溶液中:c(HCO3-)=2c(H2CO3)+c(H+)-c(OH-) B. 物质的量浓度相等的Na2SO3和NaHSO3溶液中:3c(Na+)=2[c(SO32?) + c(HSO3-)+ c(H2SO3) ] C. 同浓度的下列溶液中,① NH4HSO4 ② NH4Cl ③ NH3?H2O,c(NH4+)由大到小的顺序是:②>①>③ D. 常温下,浓度均为0.1mol/L NaA和HA溶液中pH=9,则c(HA)>c(Na+)> c(A-)> c(OH-)> c(H+) |
|
| 9. 选择题 | 详细信息 | |||||||||||||||
25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
|
已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10?8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10?5 mol/L。若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( ) A. c(K+)>c(NO3?)>c(Ag+)>c(Cl?)>c(I?) B. c(K+)>c(NO3?)>c(Cl?)>c(Ag+)>c(I?) C. c(K+)>c(NO3?)>c(Ag+)=c(Cl?)+c(I?) D. c(NO3?)>c(K+)>c(Ag+)>c(Cl?)>c(I?) |
|
| 11. 选择题 | 详细信息 |
常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是 A. 水电离出的c(H+):A点小于B点 B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-) C. 在C点,滴加的V(HN3)=12.5 mL D. 在D点,c(Na+)=2c(HN3)+2 c(N3-) |
|
| 12. 选择题 | 详细信息 |
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-).下列说法正确的是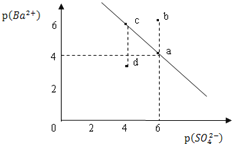 A. 该温度下,Ksp(BaSO4)=1.0×10-24 B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4) C. d点表示的是该温度下BaSO4的不饱和溶液 D. 加入BaCl2可以使溶液由 c点变到a点 |
|
| 13. 选择题 | 详细信息 |
2011年,麻省理工学院科研团队研发出一种人造树叶,它将一片半导体材料夹在两层特殊的催化剂的中间。若将人造树叶整体浸泡在溶液中,当光照在人造树叶上,就会分解水生成H2和O2,结构如图所示。下列有关人造树叶说法正确的是 A. 该装置最终将太阳能转变为电能 B. Ni、Mo、Zn基催化剂极为阳极,发生氧化反应 C. 可以将人造树叶浸泡在碱性溶液中 D. 钴基催化剂上发生反应:2H2O-4e-=4H++O2↑ |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
现有常温下的四种溶液(如下表):
|
||||||||||||||||
| 15. 选择题 | 详细信息 | |||||||||||||||
|
||||||||||||||||
| 16. 选择题 | 详细信息 |
|
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是 A. 放电时,Li+在电解质中由负极向正极迁移 B. 充电时,若转移1mole-,石墨C6电极将增重7xg C. 放电时,负极的电极反应式为LixC6-xe-= xLi++ C6 D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+ |
|
| 17. 填空题 | 详细信息 |
|
按要求填空。 (1)利用铅蓄电池电解氯化钠溶液,其在充电时阳极反应为____,放电生成的固体会附聚在电极表面,工作过程中若正极质量增重96g时,理论上电路中转移的电子数为____。 (2)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为_______。 (3)某实验小组同学对电化学原理进行了一系列探究活动。 ①如图1为某实验小组依据氧化还原反应:(用离子方程式表示)_____设计的原电池装置  ②其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图2所示。 在甲装置中铜电极反应为_______________;乙装置中石墨(1)为________极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为_________________. ③某课题组利用图3所示装置,探究NO2和O2化合生成N2O5形成原电池的过程,该电池的正极反应式应为___________。 |
|
| 18. 填空题 | 详细信息 | ||||||||||||
|
(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 mol?L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”); (2)25℃,两种酸的电离平衡常数如下表。
|
|||||||||||||
| 19. 填空题 | 详细信息 |
|
沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。 Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________; Ⅱ.已知25℃时,NH3?H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______ ;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。 Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为: CrO42- 其中第①步存在平衡:2CrO42-(黄色)+2H+ ①若平衡体系的pH=2,则溶液显____________色。 ②能说明第①步反应达平衡状态的是_____________。 A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变 ③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4?7H2O。 ④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) |
|
| 20. 实验题 | 详细信息 | ||||||||||||
孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2?3H2O及CaCO3的步骤如下: 为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
|
|||||||||||||
 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。 


