重庆市第八中学2020届高三上册期末考试理科综合化学题免费在线检测
| 1. 选择题 | 详细信息 |
|
中国是文明古国,有着许多国家宝藏,新中国成立70年来,科学技术发展取得了巨大的成就,下列说法正确的是( ) A.《千里江山图》卷中的绿色颜料的主要成分是碱式碳酸铜 B.我国古代的编钟等青铜器的主要成分是铜锌合金 C.国产大飞机 D.港珠澳大桥使用的合金材料,具有硬度大、密度大、耐腐蚀等特性 |
|
| 2. 选择题 | 详细信息 |
某有机物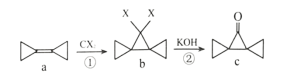 A. C. |
|
| 3. 选择题 | 详细信息 |
十九大报告中提出:要“持续实施大气污染防治行动,打赢蓝天保卫战”。防治大气污染,需重点治理汽车尾气。在催化剂作用下汽车尾气转化示意图如下,下列有关说法正确的是( )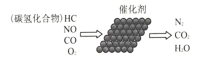 A.转化过程中所有元素均被氧化 B. C.使用催化剂是为了提高反应的平衡转化率 D.汽车尾气中的 |
|
| 4. 选择题 | 详细信息 |
|
A.常温常压下,22.4L CCl4含有NA个CCl4分子 B.50g质量分数为46%的乙醇水溶液中含有氢原子数为3NA C.工业上N2和H2反应生成了2molNH3,转移的电子数为6NA D.常温下,pH=10的Na2CO3溶液中含有的OH-数目为0.0001NA |
|
| 5. 选择题 | 详细信息 |
|
A.原子半径的大小顺序: C. |
|
| 6. 选择题 | 详细信息 | |||||||||||||||
下列实验操作能得到相应实验现象的是( )
A.A B.B C.C D.D |
||||||||||||||||
| 7. 选择题 | 详细信息 | ||||||
酒石酸是葡萄酒中主要的有机酸之一,它的结构式为
|
|||||||
| 8. | 详细信息 |
2019年诺贝尔化学奖颁给了研发锂离子电池的三位科学家。碳酸锂是一种白色粉末,微溶于水,是常用的锂离子电池原料。工业上使用锂辉石(主要成分为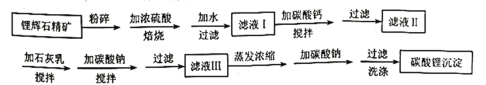 已知: (1)将 (2)滤液I中主要的金属阳离子有________。在滤液I中加碳酸钙的目的是________。 (3)在滤液Ⅱ中加入石灰乳是为了除去 (4)向滤液Ⅱ中加完石灰乳后再加碳酸钠,恰好能将 (5)某锂电池放电时的总反应式为: |
|
| 9. | 详细信息 |
|
在庆祝祖国成立70周年的大阅兵上,我国航空领域的发展成就得到了充分展示,钼及其合金在冶金和航空等方面有着广泛的应用。请回答下列有关问题: Ⅰ.已知: 则 Ⅱ.用氢气还原辉钼矿制取钼的原理为:  (1)一定温度下,在容积固定的密闭容器中进行该反应,下列能说明反应已达到平衡状态的是________(填序号)。 A. D. (2)在密闭容器中进行该反应,实验测得正、逆反应的平衡常数 (3)在密闭容器中进行该反应,不同压强下,氢气的平衡转化率与温度的关系如图2所示。 ① ② Ⅲ.电氧化法提纯钼的原理为:将已经浆化的辉钼矿 (1)辉钼矿应放入电解槽的_________(填“阴极区”或“阳极区”)。 (2)写出 |
|
| 10. 实验题 | 详细信息 |
|
叠氮化钠 已知:  请回答下列问题: (1)写出检查装置 (2) (3)装置 (4)为了让 (5)实验开始时,应先________(填“滴加一定量的浓氨水”或“点燃 (6)实验室用滴定法测定叠氮化钠样品中 ①称取 ②取 ③充分反应后,将溶液稍稀释,向溶液中加入 [已知: |
|
| 11. | 详细信息 |
|
我国已经形成对全球稀土产业链的统治力,在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题: (1)钴原子的价层电子排布图为_________,其 (2)酞菁钴结构如图所示。  ①酞菁钴中氮原子的杂化类型是________。 ②酞菁钴中所含元素原子的第一电离能由大到小的顺序是_________。 ③酞菁钴中三种非金属元素原子的电负性由小到大的顺序为________。 ④酞菁钴中 (3)稀土钴系  ① ②已知阿伏加德罗常数的值为 |
|
| 12. | 详细信息 |
甲氧基肉桂酸乙基己酯(下图中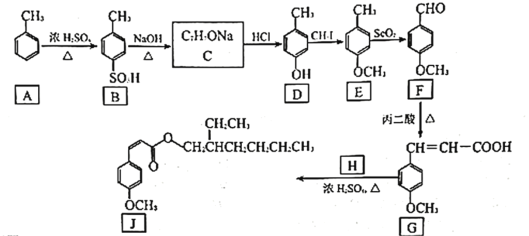 回答下列问题: (1) (2) (3) (4)  )。 )。①与 (5)以乙醇和丙二酸为原料合成聚巴豆酸乙酯  ,请补充完成以下合成路线(无机试剂可________ ,请补充完成以下合成路线(无机试剂可________ |
|
最近更新



