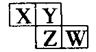2017й«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҹдёӯиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺ4019Kзҡ„еҸҷиҝ°дёӯпјҢй”ҷиҜҜзҡ„жҳҜ AпјҺеҺҹеӯҗж ёеҶ…жңү19дёӘиҙЁеӯҗВ В В В В В В В BпјҺдёӯеӯҗж•°дёә19 CпјҺж ёеӨ–з”өеӯҗж•°дёә19В В В В В В В В В В В В В DпјҺиҙЁйҮҸж•°дёә40
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҮ‘еұһж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©зўұжҖ§жңҖејәзҡ„жҳҜ AпјҺCsOHВ В В В В B.AlпјҲOHпјү3В В В C.NaOHВ В В В В В D.MgпјҲOHпјү2
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ғзҙ жҖ§иҙЁе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–зҡ„еҺҹ AпјҺеҺҹеӯҗзӣёеҜ№еҺҹеӯҗиҙЁйҮҸеўһеҠ В В В В В В BпјҺе…ғзҙ еҢ–еҗҲд»·е‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ– CпјҺж ёз”өиҚ·ж•°йҖҗжёҗеўһеҠ В В В В В В В В В В DпјҺж ёеӨ–з”өеӯҗжҺ’еёғе‘Ҳе‘ЁжңҹжҖ§еҸҳеҢ–
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ AпјҺ13C BпјҺ6Liе’Ң7Liзҡ„з”өеӯҗж•°зӣёзӯүпјҢдёӯеӯҗж•°д№ҹзӣёзӯү CпјҺ14Cе’Ң1 DпјҺ1Hе’Ң2HжҳҜдёҚеҗҢзҡ„ж ёзҙ пјҢе®ғ们зҡ„иҙЁеӯҗж•°зӣёзӯү
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„йЎ№иЎЁиҫҫдёӯжӯЈзЎ®зҡ„
BпјҺеңЁж°®еҺҹеӯҗдёӯпјҢиҙЁеӯҗж•°дёә7иҖҢдёӯеӯҗж•°дёҖе®ҡдёә7 В CпјҺMgCl2жҳҜз”ұе…ұд»·й”®жһ„жҲҗзҡ„
D. ж°ҜзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
еҺҹеӯҗеәҸж•°дёә114зҡ„е…ғзҙ пјҢе…ідәҺе®ғзҡ„йў„жөӢжӯЈзЎ®зҡ„жҳҜ В В В В В AпјҺиҜҘе…ғзҙ жҳҜйқһйҮ‘еұһе…ғзҙ В В В В В В В В В В В В BпјҺдёӯеӯҗж•°дёә114 CпјҺе…¶дҪҚзҪ®еңЁз¬¬дёғе‘ЁжңҹIVAж—ҸВ В DпјҺиҙЁйҮҸж•°дёә114
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||
|
е·ІзҹҘдёӢеҲ—е…ғзҙ зҡ„еҚҠеҫ„пјҢж №жҚ®д»ҘдёӢж•°жҚ®пјҢзЈ·еҺҹеӯҗзҡ„еҚҠеҫ„еҸҜиғҪжҳҜВ В В В В
В В В AпјҺ0.80Г— CпјҺ1.20Г—
|
|||||||||||
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺйқһйҮ‘еұһе…ғзҙ зҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В AпјҺйқһйҮ‘еұһе…ғзҙ зҡ„еҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°йғҪеӨ§ В В В BпјҺйқһйҮ‘еұһе…ғзҙ зҡ„еҺҹеӯҗйғҪжҳ“еҫ—з”өеӯҗз”ҹжҲҗзӣёеә”зҡ„йҳҙзҰ» В В В CпјҺйқһйҮ‘еұһеҚ•иҙЁйғҪжҳҜж°”дҪ“В В DпјҺжҜҸдёҖдё»ж—ҸжүҖеҢ…еҗ«зҡ„е…ғзҙ дёӯдёҚдёҖе®ҡйғҪжңүйқһйҮ‘еұһе…ғзҙ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
йҡҸзқҖж ёз”өиҚ·ж•°зҡ„йҖ’еўһпјҢеҚӨж—Ҹе…ғзҙ зҡ„жҖ§иҙЁйҖ’еҸҳ规еҫӢжӯЈзЎ®зҡ„жҳҜВ в‘ еҚ•иҙЁйўңиүІеҠ ж·ұВ В В В В В В В В В В в‘ЎеҚ•иҙЁжІёзӮ№еҚҮй«ҳВ В В В В В в‘ўеҚ•иҙЁж°§еҢ–жҖ§еўһејәВ В В В В В В В В В В В В в‘ЈзҰ»еӯҗеҚҠеҫ„еўһеӨ§В В в‘Өж°”жҖҒж°ўеҢ–зү©зЁіе®ҡжҖ§еўһејәВ В В В в‘Ҙж°ўеҢ–зү©ж°ҙжә¶ж¶Ізҡ„й…ёжҖ§еўһејә A. в‘ в‘Ўв‘Јв‘Ҙ В В В B.в‘Јв‘Өв‘ҘВ В В В C. в‘ в‘Ўв‘ў D.в‘ в‘Ўв‘ўв‘Јв‘Өв‘Ҙ
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
XгҖҒYгҖҒZгҖҒWеқҮдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢе®ғ们еңЁе‘ЁжңҹиЎЁдёӯдҪҚзҪ®еҰӮдёӢеӣҫжүҖзӨәгҖӮиӢҘYеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜеҶ…еұӮз”өеӯҗж•°зҡ„3еҖҚпјҢдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ
BпјҺжңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§пјҡZпјһWпјһX CпјҺзӣёзӯүзү©иҙЁзҡ„йҮҸжө“еәҰж°ўеҢ–зү©жә¶ж¶Ізҡ„pHпјҡ WпјһX DпјҺеӣӣз§Қе…ғзҙ зҡ„еҚ•иҙЁдёӯпјҢZеҚ•иҙЁ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯеҗ«жңүе…ұд»·й”®зҡ„зҰ»еӯҗеҢ–еҗҲзү©жҳҜ A. O2В В В В В В B. H2SВ В В В В C. CaCl2В В В В В D. NaOH
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶSO2йҒҮеҲ°зәўиүІзҡ„й…ҡй…һиҜ•ж¶ІдёӯпјҢеҸ‘зҺ°зәўиүІж¶ҲеӨұпјҢдё»иҰҒеҺҹеӣ жҳҜSO2 A. жңүжјӮзҷҪжҖ§В В В В В В В В B. жңүиҝҳеҺҹжҖ§В В В C. жңүж°§еҢ–жҖ§В В В В В В В В D. жә¶дәҺж°ҙеҗҺжә¶ж¶Іжҳҫй…ёжҖ§
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҺ’еҲ—йЎәеәҸдёӯпјҢй”ҷиҜҜзҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В AпјҺеҺҹеӯҗеҚҠеҫ„OпјңSпјңNaгҖҖгҖҖВ В В BпјҺзўұжҖ§пјҡ В В В CпјҺй…ёжҖ§пјҡ DпјҺзЁіе®ҡжҖ§пјҡ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘй’ҚеҺҹеӯҗ(23290Th)еҸҜеҸ‘з”ҹж”ҫе°„жҖ§еҸҳеҢ–пјҡ23290Th В В В AпјҺXдҪҚдәҺ第е…ӯе‘ЁжңҹВ В В В В В В В В В В В В В В В В В BпјҺXзҡ„еҚ•иҙЁиғҪдёҺеҶ·ж°ҙеү§зғҲеҸҚеә”В CпјҺXзҡ„жңҖй«ҳжӯЈд»·дёә+3д»·В В В В В В В В В В В В В DпјҺXзҡ„ж°ўж°§еҢ–зү©е…·жңүдёӨжҖ§.
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
з №пјҲAtпјүжҳҜеҚӨзҙ дёӯж ёз”өиҚ·ж•°жңҖеӨҡзҡ„е…ғзҙ пјҢжҺЁжөӢз №жҲ–з №зҡ„еҢ–еҗҲзү©дёӢеҲ—жҖ§иҙЁй”ҷиҜҜзҡ„жҳҜ AпјҺз №дёәжңүиүІеӣәдҪ“В В В В В В В В В В В В BпјҺHAtеҫҲзЁіе®ҡ CпјҺAgAtдёҚжә¶дәҺж°ҙВ В В В В В В В В В В В В DпјҺз №еҚ•иҙЁзҶ”жІёзӮ№жҜ”зўҳеҚ•иҙЁзҶ”жІёзӮ№й«ҳ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢ AпјҺдәҡзЎқй…ёй’ В В В В В В BпјҺйЈҹзӣҗВ В В В В В CпјҺи”—зі–В В В В В В В DпјҺе‘ізІҫ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ AВ жңҖеӨ–еұӮжңү1дёӘз”өеӯҗзҡ„еҺҹеӯҗйғҪжҳҜйҮ‘еұһеҺҹеӯҗ BВ йқһйҮ‘еұһе…ғзҙ е‘ҲзҺ°зҡ„жңҖдҪҺеҢ–еҗҲд»·пјҢе…¶з»қеҜ№еҖјзӯүдәҺиҜҘе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•° CВ йқһйҮ‘еұһе…ғзҙ е‘ҲзҺ°зҡ„жңҖй«ҳеҢ–еҗҲд»·дёҚи¶…иҝҮиҜҘе…ғзҙ еҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•° DВ жңҖ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁдёӢеҲ—е…ғзҙ дёӯпјҢдёҚеұһдәҺдё»ж—Ҹе…ғзҙ зҡ„жҳҜ AВ зЈ·В В В В B зўҳВ В В В В CВ й’ҷВ В В В D й“Ғ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
иӢҘз”ЁXд»ЈиЎЁFгҖҒClгҖҒBrгҖҒIеӣӣз§ҚеҚӨж—Ҹе…ғзҙ пјҢдёӢеҲ—еұһдәҺе®ғ们е…ұжҖ§еҸҚеә”зҡ„ В В В AпјҺX2пјӢH2O BпјҺX2пјӢH2 В В В CпјҺ2FeпјӢ3X2 DпјҺX2пјӢ2NaOH
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗёзғӯеҸҚеә”дёҖе®ҡжҳҜВ AпјҺв‘ в‘ўВ В В В В В В BпјҺв‘Ўв‘ўВ В В В В В CпјҺв‘ в‘ЈВ В В В В В В DпјҺв‘Ўв‘Ј
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
科еӯҰе·ҘдҪңиҖ…дёәеҝғи„Ҹз—…дәәи®ҫи®Ўзҡ„еҝғи„Ҹиө·жҗҸеҷЁзҡ„з”өжұ жҳҜд»ҘPtе’ҢZnдёәз”өжһҒжқҗж–ҷпјҢдҫқйқ дәәдҪ“еҶ…ж¶ІдҪ“дёӯеҗ«жңүдёҖе®ҡжө“еәҰзҡ„жә¶и§Јж°§гҖҒHпјӢе’ҢZn2пјӢиҝӣиЎҢе·ҘдҪңгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)жӯЈжһҒжқҗж–ҷжҳҜ_____(2)иҙҹжһҒжқҗж–ҷжҳҜ_____пјҢиҙҹжһҒз”өжһҒеҸҚеә”жҳҜ___________гҖӮ
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ |
|
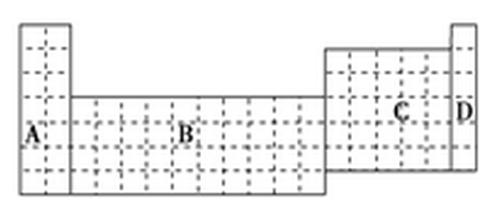
пјҲ1пјүеңЁдёҠйқўе…ғзҙ е‘ЁжңҹиЎЁдёӯе…ЁйғЁжҳҜйҮ‘еұһе…ғзҙ зҡ„еҢәеҹҹдёәВ В В В В В В В В В В В гҖӮ пјҲ2пјүзҺ°жңүз”ІгҖҒд№ҷдёӨз§Қзҹӯе‘Ёжңҹе…ғзҙ пјҢе®Өжё©дёӢпјҢз”Іе…ғзҙ еҚ•иҙЁеңЁеҶ·зҡ„жө“зЎ«й…ёжҲ–з©әж°”дёӯпјҢиЎЁйқўйғҪз”ҹжҲҗиҮҙеҜҶзҡ„ж°§еҢ–иҶңпјҢд№ҷе…ғзҙ еҺҹеӯҗж ёеӨ–Mз”өеӯҗеұӮдёҺKз”өеӯҗеұӮдёҠзҡ„з”өеӯҗж•°зӣёзӯүгҖӮ в‘ з”Ёе…ғзҙ з¬ҰеҸ·е°Ҷз”ІгҖҒд№ҷдёӨе…ғзҙ еЎ«еҶҷеңЁдёҠйқўе…ғзҙ е‘ЁжңҹиЎЁдёӯеҜ№еә”зҡ„дҪҚзҪ®гҖӮ в‘Ў з”ІгҖҒд№ҷдёӨе…ғзҙ зӣёжҜ”иҫғпјҢйҮ‘еұһжҖ§иҫғејәзҡ„жҳҜВ В В В В В В пјҲеЎ«еҗҚз§°пјүпјҢеҸҜд»ҘйӘҢиҜҒиҜҘз»“и®әзҡ„е®һйӘҢжҳҜВ гҖӮ В В В (a)е°ҶеңЁз©әж°”дёӯж”ҫзҪ®е·Ід№…зҡ„иҝҷдёӨз§Қе…ғзҙ зҡ„еқ—зҠ¶еҚ•иҙЁеҲҶеҲ«ж”ҫе…Ҙзғӯж°ҙдёӯ (b)е°ҶиҝҷдёӨз§Қе…ғзҙ зҡ„еҚ•иҙЁзІүжң«еҲҶеҲ«е’ҢеҗҢжө“еәҰзҡ„зӣҗй…ёеҸҚеә” (c)е°ҶиҝҷдёӨз§Қе…ғзҙ зҡ„еҚ•иҙЁзІүжң«еҲҶеҲ«е’Ңзғӯж°ҙдҪңз”ЁпјҢ并ж»ҙе…Ҙй…ҡй…һжә¶ж¶І (d)жҜ”иҫғиҝҷдёӨз§Қе…ғзҙ зҡ„ж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§
|
|
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁAпјӢгҖҒBпјҚгҖҒC2пјҚгҖҒDгҖҒEгҖҒFгҖҒGе’ҢHеҲҶеҲ«иЎЁзӨәеҗ«жңү18дёӘз”өеӯҗе…«з§Қеҫ®зІ’пјҲзҰ»еӯҗжҲ–еҲҶеӯҗпјүгҖӮиҜ·еӣһзӯ”пјҡ в‘ҙAе…ғзҙ жҳҜВ В В В В В В гҖҒBе…ғзҙ жҳҜВ В В В В В В В В гҖҒCе…ғзҙ жҳҜВ В В В В В В В (з”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨә)гҖӮ в‘өDжҳҜз”ұдёӨз§Қе…ғзҙ з»„жҲҗзҡ„еҸҢеҺҹеӯҗеҲҶеӯҗпјҢе…¶еҲҶеӯҗејҸжҳҜВ В В В В В В гҖӮ ⑶EжҳҜжүҖжңүеҗ«18дёӘз”өеӯҗзҡ„еҫ®зІ’дёӯж°§еҢ–иғҪеҠӣжңҖејәзҡ„еҚ•иҙЁеҲҶеӯҗпјҢе…¶еҲҶеӯҗејҸжҳҜВ В В В В В В гҖӮ в‘·FжҳҜз”ұдёӨз§Қе…ғзҙ з»„жҲҗзҡ„дёүеҺҹеӯҗеҲҶеӯҗпјҢе…¶еҲҶеӯҗејҸжҳҜВ В В В В В В В В В В В В В В В В пјҢ з”өеӯҗејҸжҳҜВ В В В В В В В В В В В В В В В В В гҖӮ в‘ёGеҲҶеӯҗдёӯеҗ«жңү4дёӘеҺҹеӯҗпјҢе…¶еҲҶеӯҗејҸжҳҜВ В В В В В В В В В В В гҖӮ в‘№HеҲҶеӯҗдёӯеҗ«жңү8дёӘеҺҹеӯҗпјҢе…¶еҲҶеӯҗејҸжҳҜВ В В В В В В В В В В В гҖӮ
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
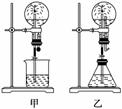
(2)收йӣҶж°Ёж°”еә”дҪҝз”Ё__________жі•пјҢиҰҒеҫ—еҲ°е№ІзҮҘзҡ„ж°Ёж°”еҸҜйҖүз”Ё________дҪңе№ІзҮҘеүӮгҖӮ В е–·жіүжҳҜдёҖз§Қеёёи§Ғзҡ„иҮӘ然зҺ°иұЎпјҢе…¶дә§з”ҹеҺҹеӣ жҳҜеӯҳеңЁеҺӢејәе·®гҖӮ (3)еӣҫз”ІдёӯпјҢдёәеҢ–еӯҰж•ҷеӯҰдёӯжүҖз”Ёзҡ„е–·жіүе®һйӘҢиЈ…зҪ®гҖӮеңЁзғ§з“¶дёӯе……ж»Ўе№ІзҮҘж°”дҪ“пјҢиғ¶еӨҙж»ҙз®ЎеҸҠзғ§жқҜдёӯзӣӣжңүж¶ІдҪ“гҖӮдёӢеҲ—з»„еҗҲдёӯдёҚеҸҜиғҪеҪўжҲҗе–·жіүзҡ„жҳҜ(гҖҖ)В В В В AпјҺHClе’ҢH2OгҖҖВ В В В В В В В BпјҺO2е’ҢH2OгҖҖВ В В В CпјҺNH3е’ҢH2OгҖҖ DпјҺCO2е’ҢNaOHжә¶ж¶ІгҖҖВ В EпјҺNO2е’ҢH2O (4)жҹҗеӯҰз”ҹз§ҜжһҒжҖқиҖғдә§з”ҹе–·жіүзҡ„е…¶д»–еҠһжі•пјҢ并и®ҫи®ЎдәҶеҰӮеӣҫд№ҷжүҖзӨәиЈ…зҪ®гҖӮ в‘ еңЁеӣҫд№ҷзҡ„й”ҘеҪўз“¶дёӯпјҢеҲҶеҲ«еҠ е…Ҙи¶ійҮҸзҡ„ AпјҺCuдёҺзЁҖзӣҗй…ёВ В В В В BпјҺNaHCO3дёҺNaOHжә¶ж¶І CпјҺCaCO3дёҺзЁҖзЎ«й…ёВ В DпјҺNH4HCO3дёҺзЁҖзӣҗй…ё в‘ЎеңЁеӣҫд№ҷй”ҘеҪўз“¶еӨ–ж”ҫдёҖж°ҙж§ҪпјҢ瓶дёӯеҠ е…Ҙй…’зІҫпјҢж°ҙж§ҪдёӯеҠ е…Ҙж°ҙеҗҺпјҢеҶҚеҠ е…Ҙи¶ійҮҸзҡ„дёӢеҲ—зү©иҙЁпјҢз»“жһңд№ҹдә§з”ҹе–·жіүгҖӮж°ҙж§ҪдёӯеҠ е…Ҙзҡ„зү©иҙЁеҸҜд»ҘжҳҜ(гҖҖгҖҖ) AпјҺжө“зЎ«й…ёВ BпјҺйЈҹзӣҗВ CпјҺзЎқй…ёй’ҫВ DпјҺзЎ«й…ёй“ң в‘ўжҜ”иҫғеӣҫз”Іе’Ңеӣҫд№ҷдёӨеҘ—иЈ…зҪ®пјҢд»Һдә§з”ҹе–·жіүзҡ„еҺҹзҗҶжқҘеҲҶжһҗпјҢеӣҫз”І________дёҠйғЁзғ§з“¶еҶ…ж°”дҪ“еҺӢејәпјӣеӣҫд№ҷ________дёӢйғЁй”ҘеҪўз“¶еҶ…ж°”дҪ“еҺӢејә(еЎ«вҖңеўһеӨ§вҖқжҲ–вҖңеҮҸе°ҸвҖқ)гҖӮ (5)еҹҺеёӮдёӯеёёи§Ғзҡ„дәәйҖ е–·жіүеҸҠзҒ«еұұзҲҶеҸ‘зҡ„еҺҹзҗҶдёҺдёҠиҝ°______(еЎ«вҖңеӣҫз”ІвҖқжҲ–вҖңеӣҫд№ҷвҖқ)иЈ…зҪ®зҡ„еҺҹзҗҶзӣёдјјгҖӮ
|
|
- еӨ§иҝһеёӮй«ҳдёүеҢ–еӯҰ2019е№ҙдёҠеҶҢйҷ„зӯ”жЎҲдёҺи§Јжһҗ
- й№ӨеІ—еёӮй«ҳдёүеҢ–еӯҰ2018е№ҙдёҠеҚҠе№ҙжңҲиҖғжөӢйӘҢж— зәёиҜ•еҚ·
- ж№–еҚ—зңҒдә”еёӮеҚҒж Ў2021еұҠй«ҳдёүдёҠеҶҢ第дәҢж¬ЎеӨ§иҒ”иҖғеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- йҷ•иҘҝй«ҳдёҖеҢ–еӯҰ2019е№ҙдёҠеҶҢжңҲиҖғжөӢйӘҢзҪ‘дёҠиҖғиҜ•з»ғд№
- еҚ—е®үеёӮ2019е№ҙй«ҳдёүеҢ–еӯҰдёҠеҚҠе№ҙжңҲиҖғжөӢйӘҢеңЁзәҝе…Қиҙ№иҖғиҜ•
- 2019-2020е№ҙй«ҳдәҢдёҠеҶҢжңҹдёӯеӨҚд№ жЈҖжөӢеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ2пјҲзҰҸе»әзңҒиҺҶ田第дёғдёӯеӯҰпјү
- йёЎиҘҝеёӮй«ҳдәҢеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёҠеӯҰжңҹпјүзҪ‘з»ңиҖғиҜ•иҜ•еҚ·
- дёҙе·қ第дәҢдёӯеӯҰй«ҳдёүеҢ–еӯҰ2019е№ҙдёӢеҶҢжңҲиҖғжөӢйӘҢе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ