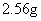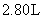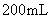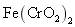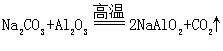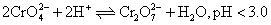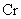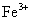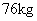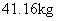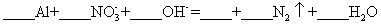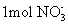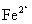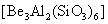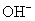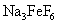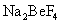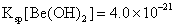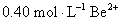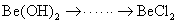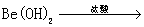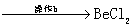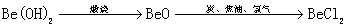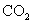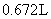高中化学必修一2020-2021学年度——金属材料综合复习题含详解(二)
| 1. | 详细信息 | ||||||||||||||||||||
|
下列由实验现象得到的结论正确的是
A . A B . B C . C D . D |
|||||||||||||||||||||
| 2. | 详细信息 |
|
下列实验现象描述正确的是 ( ) A . 将打磨过的铝片投入氢氧化钠溶液中,无明显现象 B . 将氯水滴入紫色石蕊试液中,石蕊试液先变红后褪色 C . 将红热的铜丝伸入盛有氯气的集气瓶中,剧烈燃烧,产生大量蓝色的烟 D . 将溴水和四氯化碳混合并振荡,静置后,分层,上层接近无色,下层呈橙红色 |
|
| 3. | 详细信息 |
|
下列离子方程式正确的是 A . 小苏打治疗胃酸过多: HCO B . 铝粉投入氢氧化钠溶液中: Al+2OH - =AlO C . 使用漂白粉时为了增强漂白能力向漂白粉溶液中加入少量白醋: ClO - +H + =HClO D . 过量硫酸氢铵与氢氧化钡反应: Ba 2+ +2OH - +SO |
|
| 4. | 详细信息 |
|
下列有关物质性质与用途具有对应关系的是 A . 活性铁粉易被氧化,可用作食品干燥剂 B . SO 2 具有漂白性,常用于食品增白 C . NH 4 HCO 3 受热易分解,可用作氮肥 D . 硬铝密度小、强度高,抗腐蚀能力好,用于制造飞机和宇宙飞船 |
|
| 5. | 详细信息 |
|
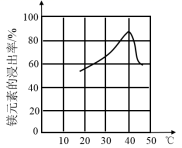
地壳中含量最多的金属元素是 ___ ,它处于元素周期表的位置是 __ , __ 。将其单质除出表面保护膜后,放入硝酸汞溶液反应一会儿取出,吸干表面溶液静置会观察到的现象是 __ ,该现象可用化学反应方程式可表示为 ___ ,写出该反应产物分别与盐酸、氢氧化钠溶液反应的化学方程式: ___ , ___ 。 |
|
| 6. | 详细信息 |
|
烧碱 (NaOH) 和纯碱 (Na 2 CO 3 ) 与硫酸、盐酸和硝酸并称为工业上的 “ 三酸两碱 ” (1) 完成下列有关 NaOH 溶液参加反应的离子方程式 ①向 NaOH 溶液中加入铝片: _______ ; ②向 NaOH 溶液中滴加少量氯化铝溶液 _______ ; ③二氧化氮与 NaOH 溶液发生氧化还原反应: _______ ; ④用热的 NaOH 溶液洗涤沾有硫单质的试管: _______ ; (2) 下列是碳酸钠和碳酸氢钠的性质比较,用 “ ①热稳定性: ②与稀盐酸反应快慢: ③物质的量相同时,消耗盐酸的物质的量: (3) 碳酸钠在工业上具有广泛的作用,碳酸钠可以用作下列工业生产主要原料的是 _______ ( 填编号 ) a. 玻璃 b. 水泥 c. 造纸 d. 海水提取镁 |
|
| 7. | 详细信息 |
|
将 Na 2 CO 3 和 NaHCO 3 的混合物加热,生成的气体 ( 假设无损耗 ) 全部通入足量的石灰水中,得到 20.0g 白色沉淀,加热后的残留物加入 200mL 盐酸恰好完全反应,生成 5.60LCO 2 气体 ( 标准状况下 ) 。试回答下列问题 ( 计算结果均保留 3 位有效数字 ) (1) 加热时发生反应的化学方程式为 _______ 。 (2) 所加盐酸的物质的量浓度为 _______ mol/L 。 |
|
| 8. | 详细信息 |
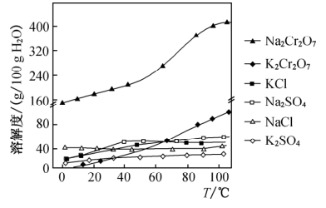
|
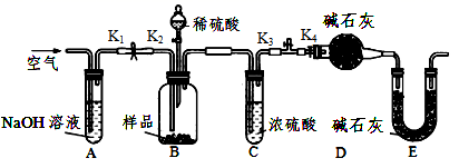
某小组同学将一定浓度 NaHCO 3 溶液加入到 CuSO 4 溶液中发现生成了沉淀。甲同学认为沉淀是 CuCO 3 ;乙同学认为沉淀是 CuCO 3 和 Cu(OH) 2 的混合物,他们设计实验测定沉淀中 CuCO 3 的质量分数。 (1) 按照甲同学的观点,发生反应的离子方程式为 _______ ; (2) 乙同学认为有 Cu(OH) 2 生成的理论依据是 _______ 用离子方程式表示 ) ; (3) 两同学利用下图所示装置进行测定: ①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 _______ 、洗涤、干燥; ②装置 E 中碱石灰的作用是 _______ ③实验过程中有以下操作步骤: a. 关闭 K 1 、 K 3 ,打开 K 2 、 K 4 ,充分反应 b. 打开 K 1 、 K 4 ,关闭 K 2 、 K 3 ,通入过量空气 c. 打开 K 1 、 K 3 ,关闭 K 2 、 K 4 ,通入过量空气 正确的顺序是 _______ ( 填选项序号,下同 ) ;若未进行步骤 _______ ,将使测量结果偏低; ④若沉淀样品的质量为 mg ,装置 D 的质量增加了 ng ,则沉淀中 CuCO 3 的质量分数为 _______ 。 |
|
| 9. | 详细信息 |
|
现有以下物质: ①熔融态 K 2 SO 4 ②稀盐酸③铝④乙醇 (C 2 H 5 OH) ⑤ NaOH 固体 ⑥ CO 2 请回答下列问题 ( 用序号 ) : (1) 以上物质能导电的是 _______ ,以上物质中属于电解质的是 _______ 。 (2) 写出 ①水溶液的电离方程式: ________ 。 (3) 根据下列离子方程式: (4) 少量 ⑥通入⑤的水溶液的离子方程式为: ___________ ; ③具有两性,既可以与酸反应,又可以与碱反应,则③与⑤反应的化学方程式为: ___________ 。 |
|
| 10. | 详细信息 |
|
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定。取废水 50g ,用 2% 的氢氧化钠溶液进行中和,当溶液 pH=7 时,用去氢氧化钠溶液 20g 。计算废水中盐酸的溶质质量分数 _______ 。 |
|
| 11. | 详细信息 |
|
(1) 除去 Na 2 CO 3 粉末中混入的 NaHCO 3 杂质用 _______ 方法,化学方程式为 _______ 。 (2) 除去氧化铜粉末中混入的氧化铝粉末通常用 _______ 试剂,离子方程式为 _______ 。 |
|
| 12. | 详细信息 |
|
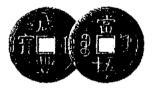
根据你学过的有关金属的知识,回答下列问题 ( 已知:铜、锌能与硝酸反应,而金不反应 ) : (1) 铜钱在我国历史上曾经是一种广泛流通的货币,如图所示,铜常用于制造货币的原因可能是 ___________ ( 填字母 ) 。 A .铜的熔点不是太高,易于冶炼,易于铸造成型 B .铜的性质不活泼,不易被腐蚀 C .我国较早地掌握了湿法冶炼铜的技术 D .自然界有大量的游离态的铜 (2) 铁制品的使用更为广泛,但是铁制品易生锈,铁锈的主要成分是 ___________ ( 填化学式,下同 ) ,常见的铁的氧化物还有 ___________ 、 ___________ 。 (3) 铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏,若使氧化铝与氢氧化钠溶液作用,反应的化学方程式为 ___________ 。 |
|
| 13. | 详细信息 |
|
向 AlCl 3 溶液中,滴加少量 NaOH 溶液,现象是 ___________ ,继续滴加 NaOH 溶液至过量,现象是 ___________ 。 |
|
| 14. | 详细信息 |
|
(4) 用洁净的铂丝蘸取 (5) 等质量的 |
|
| 15. | 详细信息 |
|
按要求解答问题 (1) 已知标准状况下,气体 A 的密度为 2.857 g·L -1 ,则气体 A 的相对分子质量为 _______ ,可能是 _______ 气体。 (2) 标准状况下, 1.92 g 某气体的体积为 672 mL ,则此气体的相对分子质量为 _______ 。 (3)CO 和 CO 2 的混合气体 18 g ,完全燃烧后测得 CO 2 体积为 11.2 L( 标准状况 ) ,则 ①混合气体在标准状况下的密度是 _______ g·L -1 。 ②混合气体的平均摩尔质量是 _______ g·mol -1 。 |
|
| 16. | 详细信息 |
|
化学是一门实用性很强的科学。请根据题意填空: (1) 钠有多种化合物,其中俗称 “ 小苏打 ” 的是 ___________ ( 填 “Na 2 CO 3 ” 或 “NaHCO 3 ”) (2) 铁有多种氧化物,其中可用做颜料、油漆的是 ___________ ( 填 “Fe 2 O 3 ” 或 “Fe 3 O 4 ”) (3) 铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装 ___________ ( 填 “浓硫酸”或“浓盐酸” ) 。 |
|
| 17. | 详细信息 | ||||||
|
Al 2 O 3 可以从铝土矿中获得,铝土矿的主要成分为 Al 2 O 3 ,含 Fe 2 O 3 、 SiO 2 等杂质。经过 “ 酸溶法 ” 或 “ 碱溶法 ” 等都可以去掉杂质得到 Al 2 O 3. 19 世纪后期,美国的霍尔和法国的埃鲁先后独立发明了电解 Al 2 O 3 法生产铝。 2Al 2 O 3 (1) 上述涉及到 Al 、 Na 、 O 、 F 、 Si 、 Fe 六种元素中,不是主族元素的是 ______ (2) 制造 “ 中国芯 ” 芯片的核心元素 Si 位于元素周期表第 ______ 周期第 ___ 族。冰晶石 (Na 3 AlF 6 ) 晶体中阴、阳离子各一种,阴离子符号 _____ 。 (3) 用 “ > ” 或 “ < ” 填空:
|
|||||||
| 18. | 详细信息 |
|
假黄金其主要成分为 Zn 、 Cu ,外观酷似黄金,具有金属特性,不法分子常用来欺骗、坑害不懂化学知识的老人和文盲。回答下列问题: (1) 不法商人以 ZnCO 3 、 CuCO 3 为原料制取假黄金反应如下: I.ZnCO 3 (a) II.CuCO 3 (d) III.ZnO(f) + CO IV.CuO + CO ①熔点:假黄金 __________ ( 填 “ 高于 ”“ 低于 ” 或 “ 等于 ”)Cu 。 ② a ~ h 中属于酸性氧化物的是 __________ ( 填字母,下同 ) ,属于金属的是 __________ ,属于盐的是 __________ 。 ③反应 III 属于 _________________ ( 填 “ 置换反应 ” 或 “ 氧化还原反应 ”) 。 (2) 真假黄金的鉴别 ①将少许假黄金置于空气中灼烧,现象为 __________ ,黄金置于空气中灼烧无明显现象。 ②将少许假黄金置于稀硫酸中,有无色气体放出,该反应的离子方程式为 ______________ ,少许黄金置于稀硫酸中现象为 ____________________________________________________ 。 |
|
| 19. | 详细信息 |
|
汽车受到猛烈撞击时,气囊内的 NaN 3 会发生分解反应生成 Na 和 N 2 。保护司机不受伤害的某气囊需要 0.065m 3 ( 标准状况 ) 的 N 2 ,该气囊中需要装入多少克 NaN 3 ? _____ |
|
| 20. | 详细信息 |
|
X 是金属 M 的碱式碳酸盐,不含结晶水。称取质量相等的样品两份,分别进行处理:一份在 H 2 中充分处理 ( 反应 1) ,收集得 0.994g 水,剩余残渣为金属 M 的单质,重 2.356g ;另一份则在 CO 中处理 ( 反应 2) ,完全反应后得到 1.245LCO 2 (101.325kPa , 0°C) ,剩余残渣和反应 1 完全相同。 (1) 通过计算,推出 X 的化学式 ______ 。 (2) 写出 X 分别和 H 2 、 CO 2 反应的方程式 ______ ( 要求系数为最简整数比 ) |
|
| 21. | 详细信息 |
|
铝镁合金有 |
|
| 22. | 详细信息 |
|
一定量的 (1) (2) 盐酸的物质的量浓度 ______ 。 |
|
| 23. | 详细信息 |
|
将足量澄清石灰水加入 250mL 碳酸钠溶液中,过滤、干燥后得到 20g 沉淀。 (1) 发生反应的离子方程式为 _______ 。 (2) 碳酸钠溶液的物质的量浓度为 _______ 。 (3) 若取出这 20g 沉淀,向其中加入足量的稀盐酸充分反应,计算最终产生的气体在标准状况下的体积为 _______ 。 |
|
| 24. | 详细信息 |
|
现有标准状况下 5.6 L H 2 在足量 Cl 2 中充分燃烧,试计算 ( 要求写出计算步骤 ) (1) 生成 HCl 的物质的量为多少? _______ 。 (2) 反应过程中,转移的电子数目有多少? _______ 。 (3) 将生成的 HCl 溶于水形成 200 mL 溶液,所得溶液的物质的量浓度为多少? _______ 。 |
|
| 25. | 详细信息 |
|
取 W g NaHCO 3 固体加热使其完全分解,将生成的 CO 2 通入足量澄清石灰水中全部吸收,生成 5.0 g CaCO 3 沉淀。试计算: (1)CaCO 3 的物质的量为 _______ mol 。 (2)NaHCO 3 固体的质量 w= _______ 。 |
|
| 26. | 详细信息 |
|
取某镀锌铁片 56.9 g , 将其投入足量稀硫酸中,镀锌铁片完全溶解,产生氢气 22.4 L ( 标准状况 ) 。试计算: (1) 产生氢气的物质的量 ___________ mol 。 (2) 镀锌铁片中铁的质量是 ___________ g 。 |
|
| 27. | 详细信息 |
|
实验室用 17.4g 的 MnO 2 与 100mL 足量的浓盐酸制取氯气: MnO 2 +4HCl( 浓 ) (1) 求生成氯气的体积 ( 标准状况 ) _______ ? (2) 求参加反应的 HCl 的物质的量 _______ ? |
|
| 28. | 详细信息 |
|
(1) 将 4.6g 钠投入到 ___ g 水中,才能使溶液中的 Na + 和 H 2 O 的个数比为 1 ∶ 20 。钠完全反应后所得溶液的溶质质量分数为 ___ 。 (2) 相同质量的钠、镁、铝与足量的稀盐酸反应时放出的氢气的质量比为 ___ 。 ( 可以不通分 ) |
|
| 29. | 详细信息 | ||||||||||||
|
为了测定镁铝合金中各成分金属的含量,可采取以下两种方法: (1) 将 8g 镁铝合金样品投入足量的氢氧化钠溶液中充分反应后,过滤,得滤渣 4.4g ,则合金样品中铝的质量分数为 _______ 。 (2) 在标准状况下进行甲、乙、丙三组实验:各取 200mL 同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
则盐酸的物质的量浓度为 ____ ( 保留三位有效数字 ) ,合金中镁铝的物质的量之比 ____ 。 |
|||||||||||||
| 30. | 详细信息 |
|
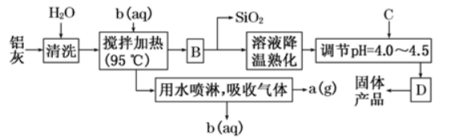
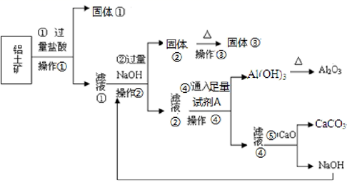
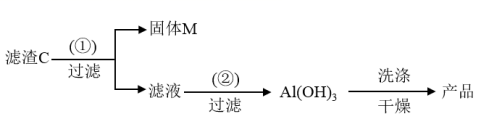
一种高效无机水处理剂 —— 聚合氯化铝晶体的化学式为 (1) 搅拌并加热操作过程中发生反应的离子方程式为 ___ 。 (2) 生产过程中实验操作 B 、 D 的名称均为 __ 。 (3) 反应中副产品 a 是 __ ,试剂 b 是 ___ ( 用化学式表示 ) 。 (4) 生产过程中可循环使用的物质是 __ ( 用化学式表示 ) 。 (5) 调节 pH=4.0~4.5 的目的是 __ 。 (6) 为得到较纯的晶体,过程中 C 物质可选用 __ 。 A. 氨水 B.NaAlO 2 C.NaOH D.Al 2 O 3 E.Al |
|
| 31. | 详细信息 |
|
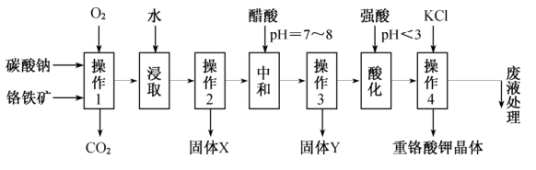
实验室以铬铁矿 ( 主要成分是 已知: ① ② 请回答下列问题: (1)① ②“ 操作 1” 的反应条件是高温,写出主要的化学反应化学方程式 _______ 。 ③“ 操作 1” 中的反应,在常温下的反应速率较慢,为使反应速率增大,除升高温度外,还可采取的措施为 _______ 、 _______ ( 写出两条 ) 。 (2) 固体 X 中主要含有 _______ ( 填写化学式 ) ,固体 Y 中主要含有 _______ ( 填写化学式 ) 。 (3) (4) 某工厂用 |
|
| 32. | 详细信息 | ||||||||||||
|
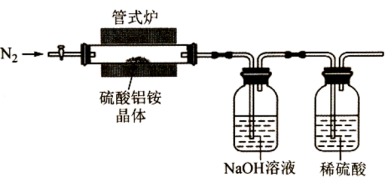
高纯超细氧化铝是一种新型无机功能材料,以硫酸铵和硫酸铝为原料制备复盐硫酸铝铵 回答下列问题: (1) 操作 ①需加入稀 H 2 SO 4 ,其目的是 ___________ 。 (2) “纯化”的方法为 ___________ 。 (3) 实验室用如图装置利用热分解法制备高纯超细氧化铝粉并对其分解气成分进行探究: 反应一段时间后,取三份 NaOH 吸收液于三支试管中分别进行如下实验,填写下表:
写出硫酸铝铵晶体高温分解的化学方程式 ___________ 。 (4) 为了测定高纯超细氧化铝粉中 Al 2 O 3 的质量分数,可用 EDTA( 简写为 H 4 Y) 标准溶液滴定。取 mg 氧化铝粉溶于盐酸,加入过量的 V 1 mLc 1 mol·L -1 EDTA 标准溶液,充分反应后,再用 c 2 mol·L -1 的 Zn 2+ 标准溶液滴定过量的 EDTA 至终点,消耗 Zn 2+ 标准溶液体积为 V 2 mL 。反应的离子方程式: Al 3+ +Y 4- =AlY - 、 zn 2+ +Y 4- =ZnY |
|||||||||||||
| 33. | 详细信息 |
|
铝和铝合金是一类重要的金属材料。回答下列问题: (1) 除去镁粉中混有的少量铝粉,加入某试剂后反应的离子方程式为 ___________ (2) 某同学在实验室用铝土矿 ( 含有 ① 操作 Ⅰ 所加物质 a 为 ___________ ( 选填 ② 滤液 Ⅱ 中溶质的用途之一是 ___________ 。 ③ 工业上在电解熔融的 a .酸 b .碱 c .盐 d .氧化物 (3) 铝与 (4) 已知: CCl 4 与水不相溶且密度比水大, Cl 2 的 CCl 4 溶液呈黄绿色, Br 2 的 CCl 4 溶液呈橙红色,且 Br 2 易从水溶液中溶入 CCl 4 中。 Cl 2 既能氧化 ① 取 ② 若在 |
|
| 34. | 详细信息 |
|
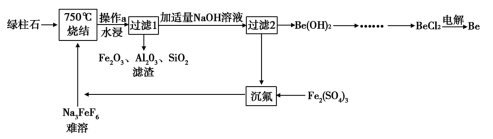
铍有 “ 超级金属 ” 之称。以绿柱石 已知 (1) 烧结冷却后,水浸之前 “ 操作 a” 的名称是 ___ 。 (2)750 ℃烧结时, (3) 已知 25 ℃时 (4) 上述流程中, “ I : II : I 中操作 b 是 ___ 。 II 中 (5) |
|
| 35. | 详细信息 |
|
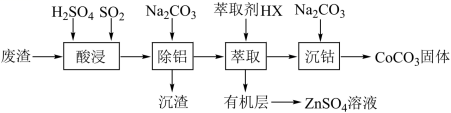
已知:碱性条件下, (1)“ 酸浸 ” 时需控制温度在 40℃ 左右,原因是 ___________ 。 (2)“ 除铝时发生反应的离子方程式为 ___________ 。 (3) 上述 “ 萃取 ” 过程可表示为 ①下列说法不正确的是 ___________ 。 A .可将废渣粉碎以提高酸浸效率 B . “ 除铝 ” 时,应加入过量的 C .可选择 D .往萃取后的有机层中加水可获得 ②请选择合适的编号,按正确的操作顺序完成萃取实验 ( 假设只放气一次 ) 倒入溶液和萃取剂 → ___________ → ___________ → ___________ → ___________ →f→ ___________ → ___________ → 使下层液体慢慢流出 →c→ 上层液体从上口倒出 ( 有的操作可重复使用 ) 。 a. 打开上口玻璃塞; b. 塞上上口玻璃塞; c. 关闭旋塞; d. 打开旋塞; e. 倒转分液漏斗振摇; f. 放在铁圈上静置; g. 手持静置。 (4)“ 沉钴 ” 时,溶液滴加过快会导致产品不纯,请解释可能原因 ___________ 。 (5) 在空气中煅烧 |
|
| 36. | 详细信息 |
|
从铝土矿 ( 主要成分 Al 2 O 3 ,含 SiO 2 、 Fe 2 O 3 、 MgO 等杂质 ) 中提取氧化铝的两种工艺流程如图: (1) 固体 A 的主要成分为 ___ ;固体 X 的主要成分有 __ 。 (2) 写出流程乙加入烧碱后 Al 2 O 3 发生的离子方程式: ___ 。 (3) 为了验证滤液 B 中含 Fe 3+ ,可取少量滤液并加入 ___ ( 填化学式 ) 。 (4) 写出灼烧步骤发生的化学反应方程式: ___ 。 (5) 滤液 E 、 K 中溶质的主要成分是 ___ ( 填化学式 ) ,写出该溶液的一种用途: ___ 。 |
|
| 37. | 详细信息 |
|
工业上用铝土矿 ( 主要成份是 Al 2 O 3 ,还含有 Fe 2 O 3 、 SiO 2 ) 提取氧化铝做冶 炼铝的原料 ( 纯净的 Al 2 O 3 ) ,某研究性学习小组设计了如下提取流程: 请回答下列问题: (1) 操作 ①的名称是 ___________ ,操作 ③用到的仪器有酒精灯、三脚架、泥三角 ____________ 。 (2) 固体 ②的颜色为 ___________ 。 (3) 流程 ④中生成 Al(OH) 3 的离子方程式是 ___________ 。 (4) 上述流程不涉及的化学反应类型是 ___________ 。 A .复分解反应 B .氧化还原反应 C .化合反应 D .分解反应 (5) 用固体 ①制备硅酸,涉及的化学反应方程式为 ___________ 、 ___________ 。 (6) 有一种含铁、硅等元素的矿石,其主要成分的化学式为 Na 2 Fe 5 (OH) 2 Si 8 O 22 ,该物质中 +2 价铁与 +3 价铁的物质的量之比为 ___________ 。将 mg 该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为 Fe 2+ ,过滤后滤液用 c mol/L 的 KMnO 4 酸性溶液与 Fe 2+ 反应,用去 VmL 溶液。该矿石中铁元素的质量分数为 ____________ ( 用含 m 、 c 、 V 的代数式表示 ) 。 |
|
| 38. | 详细信息 |
|
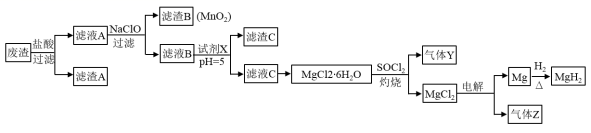
氢化镁 (MgH 2 ) 可用作供氢剂。某兴趣小组以工业废渣 ( 主要成分是 MgO ,含 Al 2 O 3 、 FeO 、 Fe 2 O 3 、 MnO 和 SiO 2 等杂质 ) 为原料制备氢化镁的流程如下: 已知: SOCl 2 遇水反应生成 SO 2 和 HCl 。请回答下列问题: (1) 滤渣 A 的主要成分是 _______ ( 填化学式 ) , SOCl 2 的作用是 _______ 。 (2) 滤液 A 和次氯酸钠反应生成 MnO 2 的离子方程式为 _______ 。 (3) 将一定量的工业废渣溶于一定体积 4mol·L -1 盐酸中,相同时间内镁元素的浸出率与温度的关系如图所示。其他条件相同,温度高于 40 ℃时,镁元素的浸出率降低的主要原因可能是 _______ 。 (4) ①试剂 X 宜选择 _______ ( 填字母 ) 。 A.NaOH B.MgO C.Mg(OH) 2 D.NH 3 ·H 2 O ②电热水器中的镁棒可防止内胆 ( 主要成分是铁 ) 被腐蚀,这种保护金属的方法叫做 _______ 。 ③已知:常温下, (5) 为充分回收金属元素,设计以滤渣 C 为原料制备高纯度氢氧化铝的较优合成路线如下。请在括号里填入合适试剂: ① _______ ; ② _______ 。 |
|
| 39. | 详细信息 |
|
用含有 A1 2 O 3 、 SiO 2 和少量 FeO·xFe 2 O 3 的铝灰制备 A1 2 (SO 4 ) 3 ·18H 2 O 。,工艺流程如下 ( 部分操作和条件略 ) : I. 向铝灰中加入过量稀 H 2 SO 4 ,过滤: II. 向滤液中加入过量 KMnO 4 溶液,调节溶液的 pH 约为 3 ; III. 加热,产生大量棕色沉淀,静置,上层溶液呈紫红色: IV. 加入 MnSO 4 至紫红色消失,过滤; V. 浓缩、结晶、分离,得到产品。 (1)H 2 SO 4 溶解 A1 2 O 3 的离子方程式是 ___________ 。 (2)KMnO 4 氧化 Fe 2+ 的离子方程式补充完整: (3) 步骤 II 的目的是 ___________ 。 (4) 已知:一定条件下, ①向步骤 III 的沉淀中加入浓 HCl 并加热,能说明沉淀中存在 MnO 2 的现象是 _________ 。 ②步骤 IV 中加入 MnSO 4 的目的是 __________ 。 |
|
| 40. | 详细信息 |
|
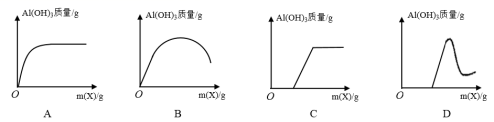
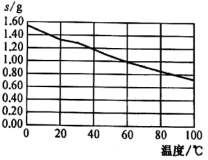
一种从废旧锂离子电池 ( 主要含 LiCoO 2 及少量 Al 、 Cu) 中回收铝、铜,并重新制备钴酸锂的工艺流程如下: 回答下列问题: (1) 向 “ 滤液 1” 中加入适量的盐酸,调节 pH 为 4.5 ,可获得 Al(OH) 3 ,写出该反应的离子方程式: _______ 。 (2) 向 “ 残渣 ” 中加入稀硫酸和 H 2 O 2 ,会放出大量气泡,写出 LiCoO 2 与 H 2 O 2 发生反应的化学方程式: _______ 。 (3) 为沉淀 Co 2 + ,向 “ 滤液 2” 中加入 (NH 4 ) 2 C 2 O 4 而不是 Na 2 C 2 O 4 。利用如下数据说明其原因: _______ 。 ( 已知 25 ℃时 0.1 mol·L -1 的 Na 2 C 2 O 4 溶液的 pH 约为 8.35 , Co(OH) 2 的 K sp =6.0×10 -15 ,假设溶液中 c(Co 2 + )=0.1 mol·L -1 ) 。 (4)RH 萃取 Cu 2 + 的原理可表示为: Cu 2 + + 2HR ⇌ CuR 2 + 2H + 。实验室中进行萃取实验用到的玻璃仪器有 _______ 、 _______ ;向有机层中加入反萃取剂 _______ ( 填化学式 ) 可将 Cu 2 + 反萃取至水层。 (5) 已知 Li 2 CO 3 的溶解度随着温度变化的曲线如图。加入 Na 2 CO 3 溶液后应进行的操作是 _______ 。 (6) 碘量法测定硫酸铜晶体结晶水含量的实验原理涉及如下反应: 2Cu 2 + + 4I - =2CuI↓ + I 2 ; CuI + SCN - =CuSCN↓ + I - ; I 2 + 2S 2 O 实验过程如下:准确称取 m g CuSO 4 ·xH 2 O 于 250 mL 碘量瓶中,加入 5 mL 1 mol·L -1 H 2 SO 4 和 100 mL 水使之完全溶解,加入 10 mL 左右 KI 溶液,充分振荡后立即用 c mol·L -1 的 Na 2 S 2 O 3 标准溶液滴定至浅黄色。然后再加入 5 mL 0.5% 淀粉溶液,继续滴至浅黄色,再加入 10% KSCN 溶液 10 mL ,使 CuI 沉淀转化为 CuSCN 沉淀,释放出吸附在 CuI 上的 I 2 ,继续用 c mol·L -1 的 Na 2 S 2 O 3 标准溶液滴定至蓝色恰好消失即为终点,滴定过程中共消耗 Na 2 S 2 O 3 标准溶液 V mL 。则 x= _______ ( 列出计算式,不必化简 ) ,若不加入 KSCN 溶液,对测定结果的影响是 _______ ( 填 “ 偏高 ”“ 偏低 ” 或 “ 无影响 ”) 。 |
|
| 41. | 详细信息 |
|
某些物质之间能发生如下反应 ( 图中有些反应的产物和反应的条件没有全部标出 ) 。其中 A 、 B 、 C 为金属单质,且 A 、 B 为短周期元素,金属 C 是目前世界上用量最大的金属。 请根据以上信息回答下列问题: (1) 写出下列物质的化学式:丙 ___________ ; H ___________ 。 (2) 写出下列反应的离子方程式: 反应 ①: ___________ 。 反应 ③: ___________ 。 反应 ⑤: ___________ 。 |
|
| 42. | 详细信息 |
|
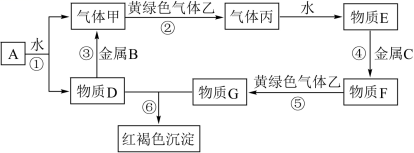
已知 A 为淡黄色固体, T 、 R 为两种常见的用途很广的金属单质, D 是具有磁性的黑色晶体, C 是无色无味的气体, H 是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体 M 。 (1) 写出下列物质的化学式: A : _______ , D : _______ , R : _______ 。 (2) 按要求写下列反应方程式: H 在潮湿空气中变成 M 的过程中的化学方程式: _______ ; B 和 R 反应生成 N 的离子方程式: _______ ; D 与盐酸反应的离子方程式: _______ 。 (3) 向 W 溶液中加入一定量 T 后,为检验所得溶液中金属阳离子,甲、乙两位同学做了如下实验:甲同学取出少量反应后溶液,加入少量 H 2 O 2 ,再滴加几滴 KSCN 溶液,发现溶液显血红色,由此得出结论有 Fe 2+ ;乙同学取出少量反应后溶液,加入少量酸性 KMnO 4 溶液,发现酸性 KMnO 4 溶液褪色,由此得出结论有 Fe 2+ 。丙同学看了实验过程后认为甲、乙同学的结论都有问题,你觉得丙同学判断甲、乙同学结论的依据是: 甲同学: _______ ; 乙同学: _______ 。 |
|
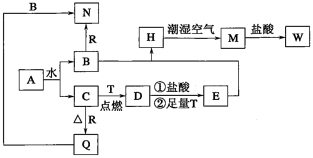
| 43. | 详细信息 |
|
有 A 、 B 、 C 、 D 四种常见的金属单质, A 在空气中燃烧生成淡黄色固体; B 为红色固体,锈蚀时变为绿色; C 在空气中加热熔化但不滴落; D 在氧气中燃烧,火星四射。根据以上信息回答下列问题: ( 1 )写出对应化学式: B _______ , C _______ , D _______ 。 ( 2 )写出下列反应离子方程式: ① A 与水: _______ ② C 与氢氧化钠溶液: _______ 。 ( 3 )写出下列化学方程式: ① A 在空气中燃烧 _______ ; ② D 在氧气中燃烧 _______ ; |
|
| 44. | 详细信息 |
|
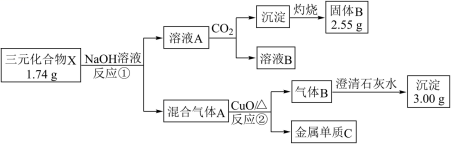
为探究由三种短周期元素构成的化合物 X( 其中一种为金属元素 ) 的组成和性质,某研究小组设计并完成了如下实验 ( 步骤中所加试剂均过量 ) 。 (1) 组成 X 的三种元素是 ___________ , X 的化学式是 ___________ 。 (2)X 与足量 NaOH 溶液反应的化学方程式是 ___________ 。 (3) 将溶液 B 加入到溶液 A 中会出现白色沉淀,该反应离子反应方程式为 ___________ 。 (4) 常温下,将金属单质 C 投入到 H 2 O 2 溶液中并加入少量稀 H 2 SO 4 ,观察到溶液变蓝色且一段时间后产生大量气泡,原因是 ___________ 。 (5) 已知气体 B 中会混有另一物质 C .请设计实验证明 C 的存在 ___________ 。 |
|
| 45. | 详细信息 |
|
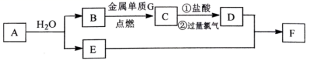
已知 A 是一种淡黄色固体,可做供氧剂, C 为具有磁性的黑色晶体, E 的焰色反应为黄色, F 为红褐色固体 ( 部分产物已略去 ) 。 (1) 物质 A 、 F 的化学式分别是 ___________ 、 ___________ 。 (2)A → B+E 的反应的化学方程式是 ___________ 。 (3) 如何检验 D 中的金属阳离子,说明具体的操作和实验现象 ___________ 。 (4)E 溶液与地壳中含量最多的金属元素的单质发生反应的离子方程式为 ___________ 。 (5)G 与 D 溶液也能发生反应,其反应的类型为 ___________ ( 填序号 ) 。 a .化合反应 b .置换反应 c .复分解反应 d .氧化还原反应 |
|
| 46. | 详细信息 |
|
A 、 B 、 C 、 D 是 4 种含铝化合物,它们之间有如下转化关系: A+NaOH→D+H 2 O B→A+H 2 O C+NaOH( 少量 )→B+NaCl B+NaOH→D+H 2 O (1) 写出化学式: B _______ , C _______ 。 (2) 写出 A 转化为 D 的化学反应方程式 _______ 。 |
|
| 47. | 详细信息 |
|
某银白色金属单质 A 在空气中加热燃烧时发出黄色火焰,得到淡黄色固体 B ;在日常生活中常见的两种金属单质 C 和 D ;其中金属单质 C 是一种两性金属,分别和盐酸、氢氧化钠反应都能生成 H 2 , D 是一种在日常生活中常见的金属单质,在潮湿的环境中易生锈;回答下列问题: (1) 写出下列物质的化学式: A _______ , B _______ , C _______ , D _______ 。 (2) 铁锈 ( 主要成分为 Fe 2 O 3 ) 和盐酸反应的化学方程式: _______ 。 |
|
| 48. | 详细信息 |
|
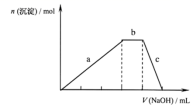
已知 X 、 Y 、 Z 是阳离子, K 是阴离子, M 、 N 是分子。它们都由短周期元素组成,且具有以下结构特征和性质: ①它们的核外电子总数都相同; ② N 溶于 M 中,滴入酚酞,溶液变红; ③ Y 和 K 都由 A.B 两元素组成, Y 核内质子数比 K 多 2 个; ④ X 和 N 都由 A 、 C 两元素组成, X 和 Y 核内质子总数相等; ⑤ X 和 K 的浓溶液在加热条件下生成 M 和 N ; ⑥ Z 为单核离子,向含有 Z 的溶液中加入少量含 K 的溶液,有白色沉淀生成,再加入过量的含 K 或 Y 的溶液,沉淀消失。 回答下列问题: (1)Y 的化学式为 _______ ; X 的电子式为 _______ (2) 试比较 M 和 N 的稳定性: M _______ ( 填 “>” 或 “<”)N 。 (3) 写出 Z 和 N 的水溶液反应的离子方程式: _______ ; (4)) 上述六种微粒中的两种可与硫酸根形成一种含三种离子的盐,向该盐的浓溶液中逐滴加入 0.1mol·L -1 的 NaOH 溶液,出现了如图中 a 、 b 、 c 三个阶段的图像,根据图像判断该盐的化学式为 _______ 。 |
|
| 49. | 详细信息 | ||||||||||||
|
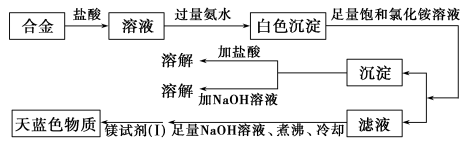
某化学课外研究小组拟对一种焰火原料 ( 由两种短周期中的常见金属元素的单质组成的合金粉末 ) 进行探究,请完成下列探究报告。 【 探究目的 】 探究该焰火原料的成分 【 资料检索 】 (1)Mg 2 + 检验方法:取 2 滴待测液,加入 2 滴 2 mol·L - 1 NaOH 溶液,再加入 2 滴镁试剂 ( Ⅰ ) 染料 ( 对硝基苯偶氮苯二酚 ) 。若出现沉淀并吸附镁试剂 ( Ⅰ ) 染料呈天蓝色,表示待测液中含有 Mg 2 + 。 ( 注: Ag + 、 Cu 2 + 、 Fe 3 + 、 NH (2)Mg(OH) 2 可溶于浓的氯化铵溶液,其他的常见不溶性碱难溶于氯化铵溶液。 【 实验探究 】 (1) 甲同学进行了初步实验,实验步骤和实验现象如下,请填写下表:
(2) 乙同学取甲同学第 ②组实验所得的溶液,加入 2 滴 NaOH 溶液及镁试剂 ( Ⅰ ) 染料,未见天蓝色物质。他得出合金中不含镁的结论,乙同学的结论 ________ ( 填 “ 正确 ” 或 “ 错误 ”) ,你的理由是 _______________________________________________________ 。 (3) 丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下: 由丙同学的实验记录可知该焰火原料是由 ________ 和 ________ 两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸的理由是 _______________________________ 。 |
|||||||||||||
| 50. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||||||||||
|
碱式碳酸铜又名孔雀石,主要成分为 Cu 2 (OH) 2 CO 3 ,呈绿色,是一种具有广泛用途的化工产品。某化学小组探究制备碱式碳酸铜的反应条件并制备少量碱式碳酸铜。 试剂: 0.25 mol·L -1 Na 2 CO 3 溶液、 0.5 mol·L -1 NaOH 溶液、 0.5 mol·L -1 Cu(NO 3 ) 2 溶液各 100mL 实验 1 :探究 Cu(NO 3 ) 2 与 NaOH 和 Na 2 CO 3 溶液配比 取三种反应溶液,以表中的比例混合,在 60℃ 条件下进行实验,并观察现象。
注: “+” 越多表示沉淀的相对量越多 实验 2 :探究反应温度 按上述实验得到的合适反应液用量,在不同温度下进行实验,并观察现象。
实验 3 :制备碱式碳酸铜 按最佳物料比取 50mL 0.5 mol·L -1 Cu(NO 3 ) 2 溶液、 50mL 0.5 mol·L -1 NaOH 溶液和相应体积的 0.25 mol·L -1 Na 2 CO 3 溶液,在最佳反应温度下进行实验,待反应完全后,静置,过滤、洗涤、干燥后,得到 2.5 g 产品。 请回答下列问题: (1) 本实验配制溶液时用到的玻璃仪器除烧杯、玻璃棒以外还有 _______ 。 (2) 制备碱式碳酸铜时, Cu(NO 3 ) 2 、 NaOH 和 Na 2 CO 3 溶液的最佳物质的量之比为 _______ ,最佳反应温度为 _______ ,本实验的加热方式为 _______ 。 (3) 请写出本实验制备碱式碳酸铜的化学方程式 _______ 。 (4) 实验 2 中在 80℃ 反应生成的沉淀中有少量黑色的物质,产生该物质的原因可能是 _______ 。 (5) 简述实验 3 中洗涤沉淀的操作 _______ 。 (6) 计算本实验的产率 _______ %( 保留三位有效数字 ) 。 |
|||||||||||||||||||||||||||||||||||||||||||||||||