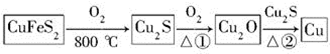2019云南高二下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
化学家借助太阳能产生的电能和热能,用空气和水作原料成功地合成了氨气。下列有关说法正确的是 A. 该合成中所有的电能和热能全部转化为化学能 B. 该合成氨过程不属于氮的固定 C. 空气、水、太阳能均为可再生资源 D. 断裂N2中的N≡N键会释放出能量
|
|
| 2. | 详细信息 |
|
下面关于化学反应的限度的叙述中,正确的是 A. 化学反应的限度都相同 B. 可以通过改变温度控制化学反应的限度 C. 可以通过延长化学反应的时间改变化学反应的限度 D. 当一个化学反应在一定条件下达到限度时,反应即停止
|
|
| 3. | 详细信息 |
|
常温下,某溶液由水电离的c(OH-)=1×10-13mol/L,对于该溶液的叙述正确的是( ) A. 溶液一定显酸性 B. 溶液一定显碱性 C. 溶液可能显中性 D. 溶液可能是pH=13的溶液
|
|
| 4. | 详细信息 |
|
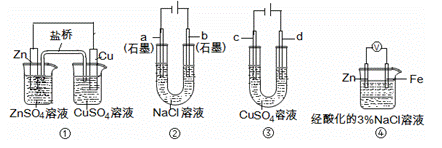
关于图中装置说法正确的是
A. 装置①中,盐桥(含有琼胶的KCl饱和溶液)中的K+移向ZnSO4溶液 B. 装置②工作一段时间后,a极附近溶液的pH减小 C. 用装置③精炼铜时,c极为纯铜 D. 装置④中电子由Zn流向Fe,装置中有Fe2+生成
|
|
| 5. | 详细信息 |
|
能够证明核外电子是分层排布的事实是( ) A. 电负性 B. 电离能 C. 非金属性 D. 电子绕核运动
|
|
| 6. | 详细信息 |
|
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( ) A. Y原子的价层电子排布式为3s23p5 B. 稳定性:Y的氢化物>Z的氢化物 C. 第一电离能:Y<Z D. X、Y两元素形成的化合物为离子化合物
|
|
| 7. | 详细信息 |
|
下列叙述中正确的是 A. NH3、CO、CO2 都 B. CH4、CCl4 都是含有极性键的非极性分子 C. HF、HCl、HBr、HI 的稳定性依次增强 D. CS2、H2O、C2H2 都是直线形分子
|
|
| 8. | 详细信息 |
|
下列有关共价键的叙述中,不正确的是( ) A. 某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的价电子数。 B. 水分子内氧原子结合的电子数已经达到饱和,故不能再结合其他氢原子。 C. 非金属元素原子之间形成的化合物也可能是离子化合物 D. 所有简单离子的核电荷数与其核外电子数一定不相等。
|
|
| 9. | 详细信息 |
|
下面的排序不正确的是( ) A. 晶体熔点由低到高:F2<Cl2<Br2<I2 B. 熔点由高到低: Na>Mg>Al C. 硬度由大到小: 金刚石>碳化硅>晶体硅 D. 晶格能由大到小: MgO>CaO>NaF> NaCl
|
|
| 10. | 详细信息 |
|
由短周期元素构成的离子化合物中,一个阳离子和一个阴离子的核外电子数之和为20, 下列说法中正确的是 A. 晶体中阳离子和阴离子个数不一定相等 B. 晶体中一定只有离子键而没有共价键 C. 所含元素一定不在同一周期也不在第一周期 D. 晶体中阳离子半径一定大于阴离子半径
|
|
| 11. | 详细信息 |
|
某烷烃的一个分子里含有9个碳原子,其一氯代物只有两种,该烷烃的名称是( ) A. 正壬烷 B. 2,6—二甲基庚烷 C. 2,2,4,4—四甲基戊烷 D. 2,3,4—三甲基己烷
|
|
| 12. | 详细信息 |
|
下列各组中的两种有机化合物,属于同系物的是( ) A. 2-甲基丁烷和丁烷 B. 新戊烷和2,2-二甲基丙烷 C. 间二甲苯和乙苯 D. 1-己烯和环己烷
|
|
| 13. | 详细信息 |
|
以下命题,违背化学变化规律的是( ) A. 石墨制成金刚石 B. 煤加氢变成人造石油 C. 水变成汽油 D. 海水淡化可以缓解淡水危机
|
|
| 14. | 详细信息 |
|
由2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应类型是:( ) A. 加成—消去—取代 B. 消去—加成—取代 C. 取代—消去—加成 D. 取代—加成—消去
|
|
| 15. | 详细信息 |
|
下列说法中正确的是( ) A. 含有羟基的有机物称为醇 B. 能发生银镜反应的有机物都是醛 C. 苯酚俗称石炭酸,酸性比碳酸强 D. 酯类在碱性条件下的水解程度大于酸性条件下的水解程度
|
|
| 16. | 详细信息 |
|
在同温同压下,某有机物和过量Na反应得到V1L氢气,另一份等量的该有机物和足量的NaHCO3反应得到V2L二氧化碳,若V1=V2≠0,则该有机物可能是 ( A )
C.HOCH2CH2OH D.CH3COOH
|
|
| 17. | 详细信息 |
|
化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( ) A. 稀的食盐水能杀死H7N9禽流感病毒 B. 涤纶、塑料、光导纤维都是有机高分子材料 C. 用电镀厂的废水直接灌溉农田,可提高水的利用率 D. 外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
|
|
| 18. | 详细信息 |
|
下列叙述中,不正确的是( ) A. 蔗糖的水解产物,在一定条件下,能发生银镜反应 B. 蔗糖是多羟基的醛类化合物 C. 蔗糖不是淀粉水解的最终产物 D. 麦芽糖是多羟基的醛类化合物
|
|
| 19. | 详细信息 |
|
下列说法中,不正确的是( ) A. 明矾净水过程中利用了胶体的吸附作用 B. 不法分子制作假鸡蛋用的海藻酸钠、氯化钙以及碳酸钙都属于盐 C. 碳纤维、黏胶纤维、醋酸纤维都属于有机高分子材料 D. 广州亚运会火炬“潮流”采用丙烷(C3H6)作燃料,充分燃烧后只生成CO2和H2O
|
|
| 20. | 详细信息 |
|
下列说法中不正确的是 A. 高吸水性树脂属于功能高分子材料 B. SiC、Al2O3的熔点很高,可用作高温结构陶瓷 C. 光导纤维、合成纤维和人造纤维都是有机高分子化合物 D. 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素
|
|
| 21. | 详细信息 |
|
21.2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。
(1)2﹣羟基异丁酸乙酯的分子式为_______,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_______个吸收峰; (2)①②的反应类型分别为_______,_______; (3)已知I为溴代烃,I→B的化学方程式为______; (4)缩聚产物F的结构简式为______; (5)下列关于 A.后者遇到FeCl3溶液显紫色,而前者不可 B.两者都可以与NaHCO3溶液反应放出CO2 C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等 D.两者都可以与氢气发生加成反应
|
|
| 22. | 详细信息 |
|
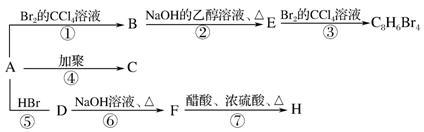
已知:CH3CH=CH2+HBr→CH3-CHBr-CH3(主要产物),1mol某烃充分燃烧后得8mol CO2 和4mol H2O ,该烃A在不同条件下能发生如下变化
(1)A的化学式:________,A的结构简式:________。 (2)上述反应中,①是________反应,⑦是________反应。(填反应类型) (3)写出C、D、E、H物质的结构简式:C_____,D_______,E_______,H________。 (4)写出D→F反应的化学方程式_______________________________。
|
|
| 23. | 详细信息 |
|
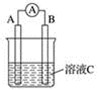
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。 (3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
|
|
| 24. | 详细信息 |
|
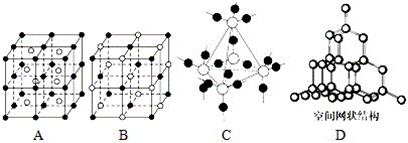
(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力。三种晶体的熔点由高到低的顺序是__。 (2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号)。 (3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__。 (4)A,B,C,D为四种晶体,性质如下: A.固态时能导电,能溶于盐酸 B.能溶于CS2,不溶于水 C.固态时不导电,液态时能导电,可溶于水 D.固态、液态时均不导电,熔点为3 500℃ 试推断它们的晶体类型:A.__;B.__;C.__;D.__。 (5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称: A.__;B.__;C.__;D.__。
|
|
| 25. | 详细信息 |
|
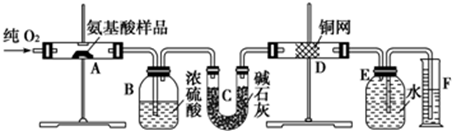
实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成,取W g该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气,按图所示装置进行实验。
回答下列问题: (1)实验开始时,首先通入一段时间的氧气,其理由是_________; (2)以上装置中需要加热的仪器有_________(填写字母),操作时应先点燃_________处的酒精灯; (3)A装置中发生反应的化学方程式是_________; (4)D装置的作用是_________; (5)读取氮气的体积时,应注意:①_________;②_________; (6)实验中测得氮气的体积为V mL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有_________(填编号) A.生成二氧化碳气体的质量 B.生成水的质量 C.通入氧气的体积 D.氨基酸的相对分子质量
|
|
| 26. | 详细信息 |
|
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,反应如 下:KHC8H4O4+NaOH=KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶 液的pH约为9.1。 (1)为标定NaOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入 250mL锥形瓶中,加入适量蒸馏水溶解,应选用_____________作指示剂,到达 终点时溶液由______色变为_______色,且半分钟不褪色。(提示:指示剂变色 范围与滴定终点pH越接近误差越小。) (2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1~2滴指示剂;②向 锥形瓶中加20mL~30mL蒸馏水溶解;③用NaOH溶液滴定到终点,半分钟不褪 色;④重复以上操作;⑤准确称量0.4000g ~ 0.6000g邻苯二甲酸氢钾加入 250mL锥形瓶中;⑥根据两次实验数据计算NaOH的物质的量浓度。 以上各步操作中,正确的操作顺序是________________________________。 (3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响? _____________。(填“有影响”或“无影响”) (4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使 实验结果____________。(填“偏大”“偏小”或“无影响”) (5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份各为0.5105g,分别溶[ 于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为 20.00mL,则NaOH溶液的物质的量浓度为________。(结果保留四位有效数字)
|
|
| 27. | 详细信息 |
|
用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。 (2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。 (3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。 (4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
|
|