安庆市高三化学上册期末考试刷题练习
| 1. 选择题 | 详细信息 | ||||||||
我国出土的文物呈现了瑰丽的历史文化。下列文物中,主要成分属于合金的是
|
|||||||||
| 2. 选择题 | 详细信息 |
|
《本草纲目》中记载“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承滴露”,其“法”是指 A.过滤 B.蒸馏 C.萃取 D.结晶 |
|
| 3. 选择题 | 详细信息 |
|
化学与生产、生活、科技、环境等密切相关。下列说法正确的是 A.“华为麒麟980”手机中芯片的主要成分是二氧化硅 B.流感疫苗要冷藏存放,以免蛋白质变性 C.“地沟油”经分馏可得汽油,用作汽车燃料 D.国产大飞机C919使用的“现代工业骨骼”碳纤维是一种新型的有机高分子材料 |
|
| 4. 选择题 | 详细信息 |
|
下列有关化学用语说法不正确的是 A.中子数为7的碳原子: B.氯乙烯的结构简式:CH2=CHCl C.羟基的电子式: D.乙酸分子的比例模型: |
|
| 5. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是 A.无色透明溶液中:Fe3+、NH4+、Br-、CO32- B.0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl-、SO42- C.使甲基橙变红的溶液中:Na+、Mg2+、SO32-、AlO2- D.水电离产生的c(H+)=10-13 mol·L-1的溶液中:K+、Ca2+、NO3-、HCO3- |
|
| 6. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法错误的是 A.1molNa2O2与过量水反应转移电子数为NA B.18g D2O和18g H2O中含有的质子数均为10NA C.0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数小于0.1 NA D.由1mol NH4Cl和少量NH3·H2O形成的中性溶液中,NH4+数目为NA |
|
| 7. 选择题 | 详细信息 |
某反应2A=3B,它的反应能量变化曲线如图所示,下列有关叙述正确的是 A.该反应为吸热反应 B.A比B更稳定 C.加入催化剂会改变反应的焓变 D.整个反应的ΔH=E1-E2 |
|
| 8. 选择题 | 详细信息 | |||||||||||||||||||||||||
除去下列物质中的杂质选用的试剂和方法最合理的是
|
||||||||||||||||||||||||||
| 9. 选择题 | 详细信息 | |||||||||
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
|
||||||||||
| 10. 选择题 | 详细信息 |
|
下列离子方程式中正确的是 A.用铁电极电解饱和食盐水:2Cl-+2H2O B.Fe(NO3)3溶液中加入过量的HI溶液2Fe3++2I-=2Fe2++I2 C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO D.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
|
| 11. 选择题 | 详细信息 |
|
氮氧化铝(AlON)属于原子晶体,是一种具有良好性能的超强透明材料。可以由反应Al2O3+C+N2 A.氮氧化铝中Al元素的化合价是+3 B.AlON和Al2O3的化学键类型相同 C.反应中每生成5.7g AlON同时生成1.12 L CO D.反应中氧化产物和还原产物的物质的量之比是2:1 |
|
| 12. 选择题 | 详细信息 |
一种用于驱动检验管道焊缝设备爬行器的CH3OH-O2燃料电池的工作原理示意如图,下列有关该电池说法正确的是 A.标况下,该电池工作时,每消耗22.4L CH3OH转移6 mol电子 B.电子由电极a经负载流向电极b,再经过氢氧化钠溶液返回电极a,形成闭合回路 C.电池工作时,OH-向电极a移动,溶液的pH减小 D.电极b上发生的电极反应为O2+4H++4e-=2H2O |
|
| 13. 选择题 | 详细信息 |
|
利用下列实验装置能完成相应实验的是 A.  该装置(秒表未画出)测定化学反应速率 该装置(秒表未画出)测定化学反应速率B. 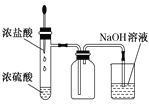 该装置制取HCl并吸收尾气 该装置制取HCl并吸收尾气C.  该装置制备纯净的NH3 该装置制备纯净的NH3D.  该装置比较MnO2、Cl2、S的氧化性 该装置比较MnO2、Cl2、S的氧化性 |
|
| 14. 选择题 | 详细信息 |
在可逆反应m A(s)+n B(g)⇌e C(g)+fD(g)过程中,当其他条件不变时,C的百分含量(用φ(C)表示)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是 A.化学方程式中,n>e+f B.反应达到平衡后,若使用催化剂,C的百分含量将增大 C.反应达到平衡后,若温度升高,化学平衡向逆反应方向移动 D.反应达到平衡后,增加A的质量有利于化学平衡向正反应方向移动 |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验操作、现象、解释或结论都正确的是
|
|||||||||||||||||||||
| 16. 选择题 | 详细信息 |
有机物X、Y的转化关系如下,下列说法正确的是 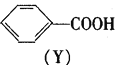 A.Y属于芳香烃 B.X转化为Y的反应属于取代反应 C.X能使Br2的CCl4溶液褪色 D.Y分子苯环上的一氯代物有5种 |
|
| 17. 选择题 | 详细信息 |
室温下,用0.1 mol·L-1的NaOH溶液滴定10.00mL 0.1 mol·L-1的CH3COOH溶液,水的电离程度随滴入NaOH溶液体积的变化曲线如图所示: 下列说法正确的是 A.该滴定过程应该选择甲基橙作为指示剂 B.从P点到N点,溶液中水的电离程度逐渐增大 C.N点溶液中c(Na+)=c(CH3COO-)+c(OH-) D.M点对应的NaOH溶液的体积为10.00mL |
|
| 18. 选择题 | 详细信息 |
钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下: 已知:MoO3、Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。下列有关叙述错误的是 A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑ B.用硫酸浸取②操作后所得滤渣,向其中加入KSCN溶液,溶液变为血红色 C.步骤③中硫酸溶液需加过量 D.由步骤④可知Na2MoO4溶解度随温度变化较小 |
|
| 19. 填空题 | 详细信息 |
| 实验测得4g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出90.8 kJ的热量。试写出甲醇燃烧热的热化学方程式________。 | |
| 20. 填空题 | 详细信息 | ||||||
现己知N2(g)和H2(g)反应生成1 molNH3(g)过程中能量变化如图所示: 根据下列键能数据计算N-H键键能为____________kJ/mol 。
|
|||||||
| 21. 实验题 | 详细信息 |
用如图所示装置进行中和热测定实验,请回答下列问题: (1)仪器A的名称为_________。 (2)取50mL HCl(0.1mol·L-1)溶液与50mL NaOH(0.1mol·L-1) 溶液在小烧杯中进行中和反应,通过实验并计算可得中和热为54.8kJ/ mol,上述实验数值与57.3kJ/mol有偏差,产生此偏差的原因可能是______(填字母序号)。 a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度 c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中 (3)若用50mL 0.1mol·L-1 CH3COOH溶液代替HCl溶液进行上述实验,测得反应前后温度的变化值会_______(填“偏大”、“偏小”、“不受影响”)。 |
|
| 22. 实验题 | 详细信息 |
|
某小组对碳与浓硝酸的反应进行探究。已知:2NaOH+2NO2=NaNO3+NaNO2+H2O,2NaOH+NO2+NO=2NaNO2+H2O。请回答下列问题: I.甲同学设计如图所示装置制备并收集NO。 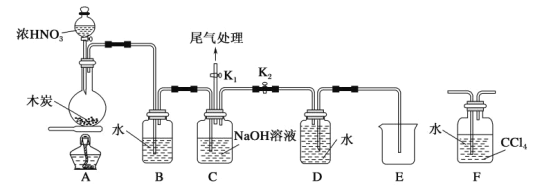 (1)碳与浓硝酸反应的化学方程式为___________。 (2)装置C的作用为__________。 (3)乙同学认为用装置F代替B更合理,理由为_______。 II.探究NO与Na2O2反应。  已知:NaNO2既有氧化性,又有还原性;J处硬质玻璃管中制得的NaNO2中含有少量NaNO3。 (4)检验上图装置气密性的方法为_________。 (5)实验结束后,设计实验证明J处硬质玻璃管中有NaNO2生成__________。(可供选择的试剂:蒸馏水、KI-淀粉溶液、KMnO4溶液、NaOH溶液、BaCl2溶液、稀硫酸) |
|
| 23. 综合题 | 详细信息 |
|
含氮化合物在工农业生产中都有重要应用。 (1)氨和肼(N2H4)是两种最常见的氮氢化物。 己知:4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。 N2H4(g)+O2(g)⇌N2(g)+2H2O(g) ΔH2=-534.0kJ/mol,化学平衡常数为K2。 则用NH3和O2制取N2H4(g)的热化学方程式为________,该反应的化学平衡常数K=________(用K1、K2表示)。 (2)对于反应:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1mol NO和0.3mol CO,反应开始进行。 ①下列能说明该反应已经达到平衡状态的是________(填字母序号)。 A.c(CO)=c(CO2) B.容器中混合气体的密度不变 C.v(N2)正=2v(NO)逆 D.容器中混合气体的平均摩尔质量不变 ②图为容器内的压强(P)与起始压强(Pº)的比值(P/Pº)随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)= ___________,平衡时NO的转化率为_____。  (3)使用间接电化学法可处理燃煤烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_________________________。  |
|
| 24. | 详细信息 | |||||||||
某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。 已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。 (1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为________,该过程温度通常控制在40℃以下的原因是________。 (2)“除铝铁”过程的NaClO3的作用是_______。 (3)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:  ①随n(C2O42-):n(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因是_______。 ②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___________。 (4)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如表所示。
|
||||||||||







