广西百色市2020-2021年高二上半期期末教学质量调研测试化学在线测验完整版
| 1. 选择题 | 详细信息 |
|
实现中国梦,离不开化学与科技的发展。下列说法不正确的是( ) A.2019年新冠肺炎“疫苗”等生物制剂需要冷藏保存 B.N95口罩所使用的熔喷布为聚丙烯,属于合成高分子材料 C.大飞机C919采用大量先进复合材料、铝锂合金等,其中铝锂合金的熔点比金属铝低 D.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅 |
|
| 2. 选择题 | 详细信息 |
|
下列化合物中,既有离子键,又有共价键的是( ) A.NaOH B.MgCl2 C.Cl2 D.NH3∙H2O |
|
| 3. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是( ) A.将Na投入到CuSO4溶液中: B.碳酸氢钠溶液与醋酸混合: C.向AlCl3溶液中加入过量的氨水: D.向氢氧化钡溶液中加入稀硫酸: |
|
| 4. 选择题 | 详细信息 |
|
化学符号是化学学科的语言。下列有关化学用语表示正确的是( ) A.H2S的电子式: 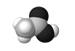 C.S2-的结构示意图: 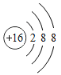 D.CCl4的电子式 D.CCl4的电子式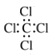 |
|
| 5. 选择题 | 详细信息 |
|
常温下,下列各组离子一定能大量共存的是( ) A.H+、K+、 C.Cl-、Cu2+、 |
|
| 6. 选择题 | 详细信息 |
|
分类是科学研究的重要方法,下列物质分类正确的是( ) A.非电解质:乙醇、氯气 B.碱性氧化物:Na2O2、CaO C.胶体:豆浆、葡萄糖溶液 D.纯净物:冰醋酸、胆矾(CuSO4∙5H2O) |
|
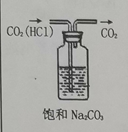
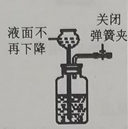
| 7. 选择题 | 详细信息 | |||||||||||||||
下列实验内容(装置操作或现象能达到相应实验目的的是( )
|
||||||||||||||||
| 8. 选择题 | 详细信息 |
|
主族元素Q、R、X、Y、Z的原子序数依次增大,且不超过20,Q原子最外层电子数是内层电子数的2倍,R、X、Y均在同一周期,R最外层电子数与最内层电子数相等,Z与R为同主族,X的单质在空气中燃烧所得产物能使品红褪色。则下列说法正确的是( ) A.原子半径大小的顺序:r(R)>r(X)>rY>r(Z) B.R的最高价氧化物对应水化物的碱性比Z的强 C.Q元素在自然界中只存在一种单质 D.元素X的简单氢化物的热稳定性比Y的弱 |
|
| 9. 选择题 | 详细信息 |
|
阿伏加德罗常数的值为NA。下列说法正确的是( ) A.78g苯中含有3NA碳碳双键 B.常温常压下,2.24LCO2中含有的原子数为0.3NA C.0.1mo∙L-1AlCl3溶液中含有Cl-数目为0.3NA D.20克D2O和18克H2O中含有的质子数均为10NA |
|
| 10. 选择题 | 详细信息 |
已知化学反应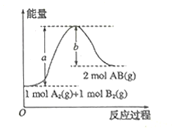 A.吸热反应一定需要加热,放热反应一定不需要加热 B.每形成2molA-B键,将吸收bkJ能量 C.断裂1mol A-A键和1mol B-B键需要吸收akJ能量 D.该反应中反应物的总能量高于生成物的总能量 |
|
| 11. 选择题 | 详细信息 |
有机物R是金银花的一种成分,具有广谱抗病毒功效,键线式为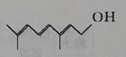 (已知 (已知A.用酸性高锰酸钾溶液可以确认R含碳碳双键 B.R能发生加成、氧化、取代反应 C.R分子中所有原子不可能共平面 D. 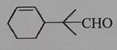 与R互为同分异构体 与R互为同分异构体 |
|
| 12. 选择题 | 详细信息 |
化学电源在日常生活和高科技领域中都有广泛应用,下列说法不正确的是( )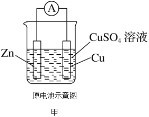  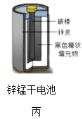 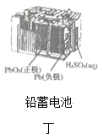 A.甲图中Zn为负极,Cu电极发生还原反应 B.乙图中正极的电极反应式为: C.丙图中锌筒作负极,发生氧化反应,锌筒会变薄 D.丁图中使用一段时间后,电解质溶液的酸性减弱,导电能力下降 |
|
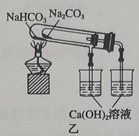
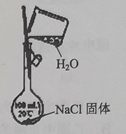
| 13. 选择题 | 详细信息 | |||||||||||||||
下列实验能达到实验目的的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
废水脱氮工艺中有一种方法是在废水中加入过量NaClO使 A.氧化剂与还原剂的物质的量之比为2:3 B.还原性: C.反应中每消耗1 mol NaClO转移2mol电子 D.反应中氮元素被氧化,氯元素被还原 |
|
| 15. 选择题 | 详细信息 |
利用海水提取溴和镁的过程如下,下列说法不正确的是( )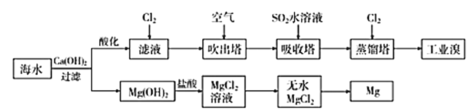 A.工业上常利用电解熔融MgCl2冶炼金属镁 B.富集溴元素过程中,空气吹出法利用了溴易挥发的性质 C.工业溴中含少量Cl2,可用NaOH溶液除去 D.若提取1molBr2,至少需要标准状况下44.8L的Cl2 |
|
| 16. 选择题 | 详细信息 |
|
某溶液中可能含有H+、NH ①若加入锌粒,产生无色无味的气体; ②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是( ) 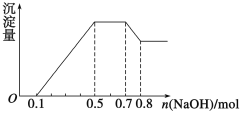 A.溶液中的阳离子只有H+、Mg2+、Al3+ B.溶液中n(NH C.溶液中一定不含CO D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1 |
|
| 17. 实验题 | 详细信息 | ||||||
Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水,且与水反应生成次氯酸,遇有机物易燃烧或爆炸,42℃以上易分解。Cl2的沸点为-34.6℃。一种制取C12O的装置如图所示。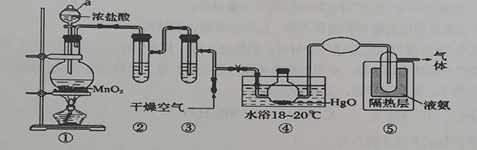 已知:Cl2O的部分性质如下表
(1)仪器a的名称为装置____________,①中发生的化学反应方程式为________。 |
|||||||
| 18. | 详细信息 |
以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下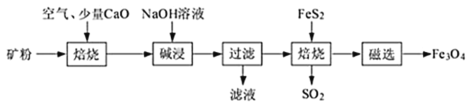 已知矿粉焙烧过程中FeS2与O2反应生成Fe2O3和SO2 (1)工业上为了加快“碱浸速率,可采取的措施有:__________________(任写2点); “碱浸”时涉及硅元素的化学反应方程式为:________________________________。 (2)向“过滤”得到的滤液中通入过量CO2后,铝元素存在的形式为化学式___________(填化学式)。“过滤”操作需要用到的玻璃仪器有:烧杯、_________、________。 (3)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,“焙烧”过程理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=___________________。 (4)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。 已知:多数金属硫酸盐的分解温度都高于600℃硫去除率=(1- 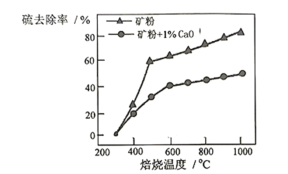 700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________。 |
|
| 19. | 详细信息 |
I.将6molCO2和8molH2充入一容积为2L的密闭容器中(温度保持不变)发生反应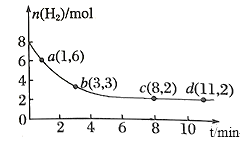 (1)在1~3min内CO2的化学反应速率为________;该可逆反应达到平衡状态时,H2转化率为________。 (2)该反应达到平衡状态的标志是__________(填字母)。 A.容器内混合气体的密度保持不变 B.CO2、H2的化学反应速率之比为1∶3 C.容器内混合气体的压强保持不变 D.CH3OH的体积分数在混合气体中保持不变 Ⅱ.微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下: (3)该电池中外电路电子的流动方向为___________(填“从A到B”或“从B到A”),A电极附近甲醇发生的电极反应式为:________。 (4)当电路中通过1mol电子时,B电极消耗标准状况下O2___________L。 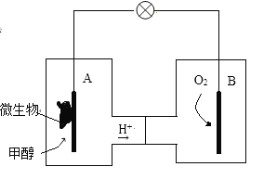 |
|
| 20. | 详细信息 |
|
铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。 (1)基态Fe原子的核外电子排布式为______________。 (2)实验室可用KSCN、苯酚( 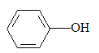 )来检验Fe3+,C、N、O三种元素的第一电离能由大到小的顺序为______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为___________。 )来检验Fe3+,C、N、O三种元素的第一电离能由大到小的顺序为______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为___________。(3)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含_____mol (4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。在该晶胞中,与Fe紧邻且最近的Fe数目为_________个,若晶胞的参数为d nm,则铁镁合金的密度为_________________g∙cm-3(不必化简,用NA表示阿伏加德罗常数)。 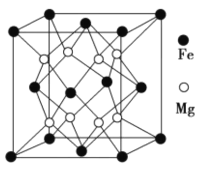 |
|
| 21. | 详细信息 |
I.在一恒容的密闭容器中充入0.1 mol L-1CO2、0.1 mol L-1 CH4,在一定条件下发生反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g),测得CH4平衡转化率与温度、压强关系如图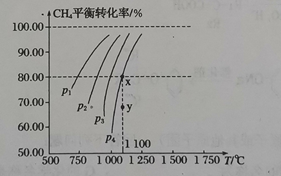 (1)该反应的△S___________0,△H__________0(填“>”或“<”) (2) (3)1100℃时该反应的平衡常数为________________(保留小数点后两位) Ⅱ.常温下,0.1000 mol L-1 NaOH溶液滴定20.00 mL 0.100 0 mol﹒L-1CH3COOH溶液所得滴定曲线如下图。 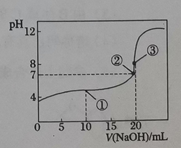 (4)下列说法正确的是_____________(填字母) A.点①所示溶液中:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) B.点②所示溶液中:c(CH3COO-)=c(Na+)=c(OH-)=c(H+) C.点③所示溶液中离子浓度的大小关系为: c(Na+)>c(OH-)>c(CH3COO-)>c(H+) D.水的电离程度:③>②>① (5)若pH=2的CH3COOH与pH=12的NaOH等体积混合,离子浓度由大到小的顺序为____________________________________。 (6)用铜作电极电解NaOH溶液的总反应的化学方程式为:____________________。 |
|
| 22. | 详细信息 |
氯贝特的化学名称为对氯苯氧异丁酸乙酯,是一种降血脂药,其合成路线如下: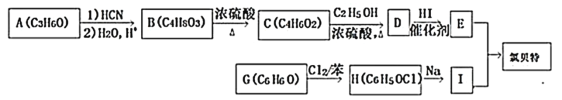 已知:①D中含有碳碳双键,核磁共振氢谱显示A中只有一种化学环境的氢原子。 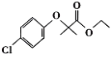 ② 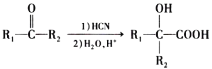 ③ 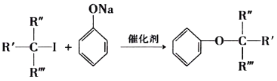 (R代表H原子或其他原子团),回答下列问题: (1)A中官能团的名称为___________,G的化学名称是________________,C→D的反应类型为________________________。 (2)H的结构简式为____________________________。 (3)由B生成C的化学方程式为________________________________。 (4)请你写出具有相同官能团的C的一种同分异构体的结构简式:_________(任写一种) (5)参照上述合成路线,以苯酚和2-甲基丙烯为原料(无机试剂任选),设计制备苯叔丁醚( |
|
高中化学 试卷推荐
- 武威市高三化学2019年下半年月考测验网上考试练习
- 2017-2018年高二上学期12月月考化学考试题(四川省成都外国语学校)
- 高中化学人教版 必修1 第一章 从实验学化学 2.化学计量在实验中的应用 物质的量浓度
- 2018届高三上半期期中考试化学考试题(黑龙江省哈尔滨师范大学附属中学)
- 2017-2018年高一12月月考化学考卷带参考答案和解析(宁夏育才中学孔德校区)
- 2018届高三教学质量检测考试理综-化学考试题(江西名校学术联盟)
- 2017-2018年高二下学期期末考试化学考题带答案和解析(江苏省溧水高级中学)
- 2016-2017年高一上学期化学期中考试在线测验(江西省赣州市兴国三中兴国班)
最近更新