2018届高三上半期期中考试化学考试题(黑龙江省哈尔滨师范大学附属中学)
| 1. | 详细信息 |
|
下列有关说法正确的是 A. 陶瓷、水晶、水泥、玻璃都属于硅酸盐产品 B. 糖类、油脂、蛋白质都能发生水解反应 C. 进行中和热的测定实验时,必须用到两个量筒和两个温度计 D. “血液透析”利用了胶体的渗析原理 |
|
| 2. | 详细信息 |
|
对中国古代著作涉及化学的叙述,下列解读错误的是 A. 《天工开物》中“凡石灰,经火焚炼用”里的“石灰”指的是Ca(OH)2 B. 《黄白第十六》中“曾青涂铁,铁赤如铜”,“ 曾”青是指可溶性铜盐 C. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 D. 《汉书》中“高奴县有洧水可燃”这里的“洧水”指的是石油 |
|
| 3. | 详细信息 |
某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度分析,下列选项正确的是( ) A. 实验①、②所涉及的物质均为电解质 B. 实验②、③均为放热反应实验 C. ②、③均未发生氧化还原反应 D. 实验①、③反应制得的物质均为纯净物 |
|
| 4. | 详细信息 |
|
下列反应中,反应后固体物质增重的是 A. 氢气通过灼热的CuO粉末 B. 二氧化碳通过Na2O2粉末 C. 铝与Fe2O3发生铝热反应 D. 将锌粒投入Cu(NO3)2溶液 |
|
| 5. | 详细信息 |
|
下列过程中,共价键被破坏的是 ①碘升华②溴蒸气被木炭吸附③酒精溶于水④HCl气体溶于水⑤冰融化⑥NH4Cl受热⑦氢氧化钠熔化⑧(NH4)2SO4溶于水 A. ④⑥ B. ④⑥⑧ C. ①②④⑤ D. ①④⑥⑦ |
|
| 6. | 详细信息 |
|
下列各组中的物质均能发生加成反应的是 A. 乙烯和乙醇 B. 苯和氯乙烯 C. 乙酸和溴乙烷 D. 丙炔和丙烷 |
|
| 7. | 详细信息 |
|
下列关于化学与环境的叙述中错误的是 A. 用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ B. 将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水 C. “煤改气”、“煤改电”等工程有利于减少雾霾 D. 使用无铅汽油的汽车尾气不会污染空气 |
|
| 8. | 详细信息 | |||||||||||||||
下列实验方案能达到实验目的是
|
||||||||||||||||
| 9. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A. 1 mol FeI2与1 mol Cl2反应时转移的电子数为3NA B. 2 g H218O与D216O的混合物中所含中子、电子数目均为NA C. 电解精炼铜,当转移了NA个电子时阳极溶解了64g铜 D. pH=1的H2SO4溶液10 L,含H+的数目为2NA |
|
| 10. | 详细信息 | ||||||||||||||||||||
下列各组离子能大量共存,当加入相应试剂后,发生反应的离子方程式正确的是
|
|||||||||||||||||||||
| 11. | 详细信息 |
|
下列说法中正确的是 A. 已知t1℃时,反应C+CO2 B. 恒压容器中发生反应N2+O2 C. 当一定量的锌粉和过量的6mol?L-1盐酸反应时,为了减慢反应速率,又不影响产生H2的总量,可向反应器中加入少量的CuSO4溶液 D. 对于工业合成氨反应N2+3H2 |
|
| 12. | 详细信息 |
“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法正确的是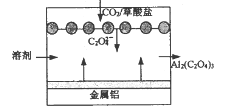 A. 该装置是将电能转变为化学能 B. 正极的电极反应为:C2O42--2e-=2CO2 C. 每得到1 mol草酸铝,电路中转移3 mol电子 D. 利用该技术可捕捉大气中的CO2 |
|
| 13. | 详细信息 |
下列有关装置图的叙述中正确的是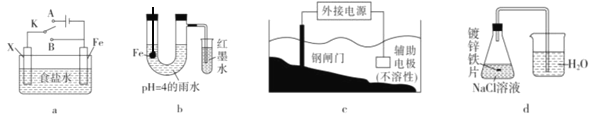 A. 图a中,如果X为锌电极,开关K放到A处或放到B处都能使铁电极受到保护 B. 图b小试管中的导管开始一段时间内液面上升 C. 为保护钢闸门,图c中的钢闸门应与外接电源的正极相连 D. 图d的右侧烧杯中,导管口有气泡冒出 |
|
| 14. | 详细信息 |
|
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是( ) A. M元素存在同素异形体 B. M元素为非金属元素 C. M的最高价氧化物对应的水化物都是强酸 D. 常温下,能稳定存在的M的氧化物都是酸性氧化物 |
|
| 15. | 详细信息 |
|
已知:NH3?H2O(aq)与H2SO4(aq)反应生成1mol正盐的ΔH =-24.2 kJ?mol-1。强酸、强碱稀溶液反应的中和热ΔH =-57.3 kJ?mol-1,则NH3?H2O在水溶液中电离的ΔH等于 A. +45.2 kJ?mol-1 B. -45.2 kJ?mol-1 C. +69.4 kJ?mol-1 D. -69.4 kJ?mol-1 |
|
| 16. | 详细信息 | ||||||||||||||||||||||||||||
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2
分析实验数据所得出的结论不正确的是( ) |
|||||||||||||||||||||||||||||
| 17. | 详细信息 |
下列图示与对应的叙述相符的是 A. 图1所示,A→C反应的ΔH =E1-E2 B. 图2所示,金刚石比石墨稳定 C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3 D. 图4所示,图中阴影部分面积的含义是(υ正-υ逆) |
|
| 18. | 详细信息 |
截至到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW。下列左图为光伏并网发电装置,右图为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是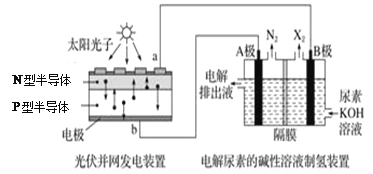 A. 左图中N型半导体为正极,P型半导体为负极 B. 右图溶液中电子流向为从B极流出,从A极流入 C. X2为氧气 D. 工作时,A极的电极反应式为CO(NH2)2+8OH-?6e-=CO32-+N2↑+6H2O |
|
| 19. | 详细信息 |
|
反应4NH3 (g) +5O2(g) A. 2分钟反应放出的热.量值小于0.1akJ B. 用氧气表示2分钟的反应速率:v(O2)=0.05mol ?L-1 ?min-1 C. 2分钟内NH3的转化率是50% D. 2分钟末 c(H2O)=0.6mol/L |
|
| 20. | 详细信息 |
NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是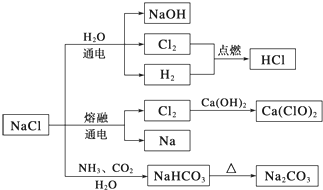 A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异 B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中 C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 D.图示转化反应都是氧化还原反应 |
|
| 21. | 详细信息 |
甲图是部分短周期元素的常见化合价与原子序数的关系图: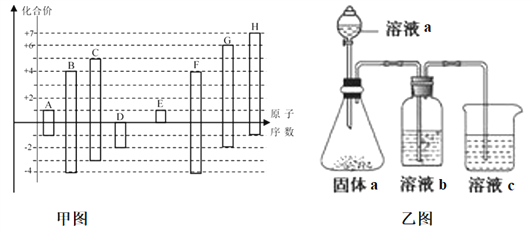 请回答下列问题: (1)D元素在周期表中的位置为___________,D和G的简单氢化物中沸点高的是___________ (写化学式),A和E形成的化合物的电子式为_____________。 (2)D、E、G、H的简单离子半径由大到小的顺序为__________________________。(用化学式表示) (3)二元化合物X是含有C元素的18电子分子,1molX(l)在25℃ 101kPa下完全燃烧放出622kJ的热量,写出表示X燃烧热的热化学方程式________________________________。 (4)H的最高价氧化物对应的水化物的浓溶液不稳定,受热可分解,产物之一是H的单质,且当有28mol电子转移时,常温共产生9mol气体,写出该反应的化学方程式___________________________________。 (5)由上述元素中的几种组成a、b、c各物质,某同学设计实验用乙图装置证明元素B、C、F的非金属性强弱(其中溶液b和溶液c均为足量)。 ①溶液a和b分别为________,________(填化学式)。 ②溶液c中的离子方程式为__________________________________________。 ③请从原子结构的角度解释非金属性C>B的原因 ____________________________________________________。 |
|
| 22. | 详细信息 | ||||||||||||
|
甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下: ①CO(g)+2H2(g) ②CO2(g)+3H2(g) ③CO2(g)+H2(g) 回答下列问题: (1)已知反应①中的相关的化学键键能数据如下:
|
|||||||||||||
| 23. | 详细信息 |
下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极,e、f是小试管。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。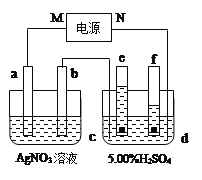 请回答下列问题: (1)直流电源中,M为_______极。 (2)Pt电极上生成的物质是_______,其质量为______g。 (3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:__________。 (4)AgNO3溶液的浓度________(填增大、减小或不变。下同),H2SO4溶液的pH_________。 (5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。 |
|
| 24. | 详细信息 |
可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成NO和NO2的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。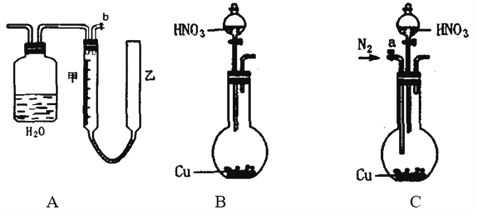 请回答下列问题: (1)实验中气体(NO和NO2)发生装置应选择___________(填装置序号)。 (2)实验中气体(NO和NO2)通入C装置,请在下图的广口瓶中将导气管画出______。 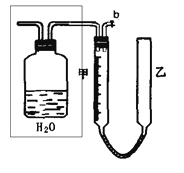 (3)连接好装置,检查气密性后,应进行的操作: 第一:打开b,向C装置的乙管中加适量水; 第二:_________________________________________________________________________; 第三:将分液漏斗颈上的玻璃塞打开,再将分液漏斗下面的活塞拧开,向烧瓶中加入浓硝酸,与铜反应。 (4)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应将乙管_______(填“向上”或“向下”)移动,使________________________。 (5)实验后若量气管中气体的体积(已换算成标准状况)为V(L),C中硝酸的物质的量为n mol,则用含n和V的式子表示m=____________________________(结果可不必化简)。 |
|
| 25. | 详细信息 |
邻苯二甲酸二丁酯DBP是一种常见的塑化剂,可以乙烯和邻二甲苯为原料合成,合成过程如图所示: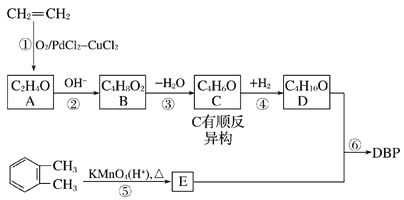  请回答下列问题: (1)DBP的分子式为________________,C的顺式结构为________________。 (2)B中含有的官能团名称为________________,反应③的类型为________反应。 (3)写出下列反应的化学方程式 反应③______________________________________________________________ 反应⑥_______________________________________________________________ (4)E的一种同分异构体F,,苯环上含有两个取代基,能与NaOH溶液反应,且1 mol F完全反应消耗3 mol NaOH,写出F所有可能的结构简式:_______________________________________________________________。 (5)检验C中碳碳双键的方法_______________________________________。 |
|



