2017-2018年高一12月月考化学考卷带参考答案和解析(宁夏育才中学孔德校区)
| 1. | 详细信息 |
|
下列对反应2FeBr2+3Cl2=2FeCl3+2Br2的有关说法正确的是 (? ) A. 被氧化的元素是铁元素 B. 氧化产物是Br2 C. 还原产物是FeCl3 D. FeBr2中两种元素都被氧化 |
|
| 2. | 详细信息 |
|
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂等。下列反应与C+H2O(g) A. 3NO2+H2O=2HNO3+NO B. Na2O+H2O=2NaOH C. 2F2+2H2O=4HF+O2 D. 3Fe+4H2O(g) |
|
| 3. | 详细信息 |
|
实验室制取少量N2常利用的反应是NaNO2+NH4Cl A. NaNO2是还原剂 B. 生成1 mol N2时转移的电子为3 mol C. NH4Cl中的N元素被还原 D. N2既是氧化剂又是还原剂 |
|
| 4. | 详细信息 |
|
用下列方法均可制得氧气: ①2KClO3 ②2HgO ③2KMnO4 若要制得相同质量的氧气,反应中电子转移数目之比为(? ) A. 3:1:1 B. 3:1:4 C. 1:1:1 D. 2:1:1 |
|
| 5. | 详细信息 |
|
下列化学反应的离子方程式错误的是 ( ) A. Al(OH)3与盐酸反应:Al(OH)3+3H+===Al3++3H2O B. Al2O3溶于过量NaOH溶液:Al2O3+2OH-===2AlO C. 铁溶于稀H2SO4:Fe+2H+===Fe2++H2↑ D. Al(OH)3溶于NaOH溶液:Al(OH)3+3OH-===AlO |
|
| 6. | 详细信息 |
|
某无色溶液中放入铝片有氢气产生,则下列离子在该溶液中肯定不能大量存在的是( ) A. Mg2+ B. Na+ C. S2- D. HCO3- |
|
| 7. | 详细信息 |
|
用铝箔包裹0.1 mol金属钠,用钉扎出一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则得到的气体为(标准状况)( ) A. 氧气和氢气的混合气体 B. 1.12升氢气 C. 大于1.12升氢气 D. 小于1.12升 |
|
| 8. | 详细信息 |
|
下列实验描述,符合事实的是( ) A. 金属钠暴露在空气中,表面变暗,生成黄色固体氧化钠 B. 用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热产生白色固体 C. 用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热 D. 用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来 |
|
| 9. | 详细信息 |
|
Na、Mg、Al各0.1mol,分别投入到盛有100mL 0.5mol/L盐酸中,充分反应后产生的氢气 A. Na最多 B. Mg最多 C. Al最多 D. 一样多 |
|
| 10. | 详细信息 |
|
设nA代表阿伏加德罗常数(NA)的值,下列说法正确的是( ) A. 1 mol Na在空气中完全燃烧,转移的电子数为2nA B. 常温下,2.7 g铝与足量NaOH溶液反应,消耗0.1nA个水分子 C. 0.1 mol Fe与足量水蒸气反应生成H2的分子数为0.1nA D. 11.2 L Cl2含有的原子数为nA |
|
| 11. | 详细信息 |
|
将一小块钠投入FeCl3溶液中,下列有关实验结果的预测正确的是( ? ) A. 钠溶解,有铁析出,并有气体产生 B. 只有气体产生 C. 只有沉淀产生 D. 既有沉淀产生,又有气体产生 |
|
| 12. | 详细信息 |
|
用某种方法可除去下列物质中所含的少量杂质(括号内为杂质),其中加适量的盐酸能达到除杂质目的的是( ) A. NaHCO3(Na2CO3) B. NaCl(NaOH) C. Na2SO4(Na2CO3) D. Na2CO3(NaOH) |
|
| 13. | 详细信息 |
|
将7.2gCO和H2的混合气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加 ( ) A. 2.1g B. 3.6g C. 7.2g D. 无法确定 |
|
| 14. | 详细信息 |
|
下列有关物质的用途叙述错误的是 (? ) A. 碳酸氢钠在医疗上可用于治疗胃酸过多 B. 钠和钾的合金可用于制原子反应堆的导热剂 C. 碳酸钠可用于玻璃,制皂,造纸、纺织等工业 D. 氧化钠可用来作漂白剂 |
|
| 15. | 详细信息 |
|
在1.0 L 0. lmol/L的纯碱溶液中.不断搅拌并逐滴加入1.2 L 0.05mol/L盐酸。完全反应后,在标准况下生成二氧化碳的体积为 A. 1.344 L B. 2.240 L C. 0.672 L D. 0 L |
|
| 16. | 详细信息 |
|
镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( ) A.Al3+ B.Cu2+ C.AlO2- D.Mg2+ |
|
| 17. | 详细信息 |
|
实验室中要使KAl(SO4)2溶液中Al3+的全部沉淀出来,最适宜的试剂是 ( ) A. NaOH溶液 B. 氨水 C. Ba(OH)2 D. 盐酸 |
|
| 18. | 详细信息 |
如图所示,下列说法不正确的是? ( )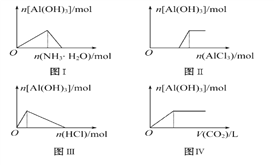 A. 图Ⅰ表示向AlCl3溶液中滴加氨水至过量 B. 图Ⅱ表示向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡 C. 图Ⅲ表示向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 D. 图Ⅳ表示向NaAlO2溶液中缓慢通入二氧化碳至过量 |
|
| 19. | 详细信息 |
|
实验室在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的( ) A. 锌粉 B. 铁粉 C. 硫酸铁 D. 盐酸 |
|
| 20. | 详细信息 |
|
下列离子方程式正确的是( ) A. 铁与FeCl3溶液反应:Fe+Fe3+=2Fe2+ B. Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ C. FeCl2溶液与Cl2反应:Fe2++Cl2=Fe3++2Cl- D. Fe(OH)3与盐酸反应:Fe(OH)3+3H+=Fe3++3H2O |
|
| 21. | 详细信息 |
|
下列离子的检验方法合理的是( ) A. 向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ B. 向某溶液中通入Cl2,然后再加入KSCN溶液变红色,则原溶液中含有Fe2+ C. 向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+ D. 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明溶液中含有Fe2+,不含有Mg2+ |
|
| 22. | 详细信息 |
|
下列离子的检验方法合理的是( ) A. 向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+ B. 向某溶液中通入Cl2,然后再加入KSCN溶液变红色,则原溶液中含有Fe2+ C. 向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+ D. 向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明溶液中含有Fe2+,不含有Mg2+ 【答案】C 【解析】试题分析:A.KSCN溶液与Fe3+溶液作用的方程式为:Fe3++3SCN-?Fe(SCN)3,而Fe2+与KSCN溶液不反应,如果该溶液既含Fe3+,又含Fe2+,滴加KSCN溶液,溶液呈红色,证明存在Fe3+而不能证明没有Fe2+,故A错误;B.若原溶液中含Fe2+,通入Cl2,氯气将Fe2+氧化成Fe3+,滴加KSCN溶液后显红色,若原溶液中不含Fe2+,含有Fe3+,通入Cl2,加入KSCN溶液同样可以变血红色,故B错误;C.加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+,故C正确;D.氢氧化镁为白色沉淀,能被红褐色沉淀掩盖,无法确定,故D错误;故选C。 考点:考查物质的检验及鉴别。 【题型】单选题 【结束】 22 【题文】关于Na2CO3和NaHCO3性质的有关叙述正确的是 A. 在水中的溶解性:Na2CO3<NaHCO3 B. 热稳定性:Na2CO3<NaHCO3 C. 与酸反应的快慢:Na2CO3<NaHCO3 D. Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
|
| 23. | 详细信息 |
|
现有下列反应: ①、2H2O+Cl2+SO2=H2SO4+2HCl ②、 KMnO4+ HCl(浓)= KCl+__MnCl2+___Cl2↑+___H2O 针对上述两个反应回答: (1)配平②的化学方程式________; (2)用单线桥标出①中电子转移的方向和数目________; (3)Cl2、SO2和KMnO4的氧化性强弱顺序为____; (4)反应①中氧化产物和还原产物的物质的量之比为___; (5)反应②中氯化氢表现出的性质是___。 A.还原性 B.酸性 C.氧化性 |
|
| 24. | 详细信息 |
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。 (1)写出代表各线段发生的反应的离子方程式: OD段________________________________________________, DC段________________________________________________。 (2)原溶液中Mg2+、Al3+的物质的量浓度之比为________。 (3)图中C点表示当加入______mol NaOH时,Al3+已经转化为_____,Mg2+已经转化为______。 (4)图中线段OA∶AB=________。 |
|
| 25. | 详细信息 |
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化: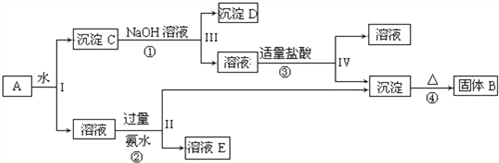 据此回答下列问题: (1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____. (2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式 沉淀固体B______;C________;沉淀D_____;溶液E________. (3)写出①、②、③、④四个反应方程式 ①_________________________; ②________________________; ③________________________; ④________________________. |
|
| 26. | 详细信息 |
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化: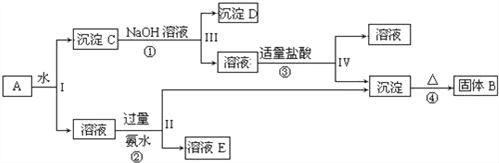 据此回答下列问题: (1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____. (2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式 沉淀固体B______;C________;沉淀D_____;溶液E________. (3)写出①、②、③、④四个反应方程式 ①_________________________; ②________________________; ③________________________; ④________________________. 【答案】 过滤 Al2O3 Al2O3、Fe2O3 Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2NaOH+3H2O=2Na[Al(OH)4] 2KAl(SO4)2+6 NH3.H2O=K2SO4+3(NH4)2SO4+2Al(OH)3↓ Na[Al(OH)4]+HCl=NaCl+H2O+Al(OH)3↓ 2Al(OH)3 【解析】KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C为Al2O3和Fe2O3;由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4; (1)溶液和沉淀的分离利用过滤; (2)由上述分析可知B为Al2O3,C为Al2O3、Fe2O3,D为Fe2O3 溶液E为K2SO4、(NH4)2SO4; (3)反应①为Al2O3+2NaOH+3H2O=2Na[Al(OH)4], 反应②为2KAl(SO4)2+6 NH3.H2O=K2SO4+3(NH4)2SO4+2Al(OH)3↓, 反应③为Na[Al(OH)4]+HCl=NaCl+H2O+Al(OH)3↓, 反应④为2Al(OH)3 点睛:考查无机物的推断,综合考查元素化合物性质,侧重Al、Fe及其化合物性质的考查,注意氧化铝的两性,明确发生的化学反应为解答的关键,由转化关系图可知,向沉淀C中加NaOH溶液,Fe2O3不反应,沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E为K2SO4、(NH4)2SO4,经过蒸发、结晶,得到K2SO4和(NH4)2SO4,然后结合物质的性质及化学用语来解答。 【题型】填空题 【结束】 26 【题文】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可发生反应。应用如图所示装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下Fe与水蒸气反应的实验。  请回答该实验中的问题。 (1)写出Fe与水蒸气反应的化学方程式:____________________________________。 (2)实验前必须对整套装置进行的操作是__________________________。 (3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_________________________。 (4)干燥管中盛装的物质可以是________________,作用是_______________。 (5)试管中收集到的气体,若要在A处玻璃管口处点燃该气体,则必须对该气体进行__________,目的是:____________。 |
|
最近更新



