2019届高三上半期第一次教学质量检测化学考题(福建省漳州市)
| 1. | 详细信息 |
|
下列有关化学与生产、生活的说法,错误的是 A. “落汤螃蟹着红袍”发生了物理变化 B. 利用植物油的氢化反应可获得人造脂肪 C. 推广使用全降解塑料有助于消除“白色污染” D. 二氧化硅可用于制造光导纤维 |
|
| 2. | 详细信息 |
|
下列有关化学用语或基本概念说法正确的是 A. HClO的结构式为:H-Cl-O B. CO2的比例模型 C. 质子数与中子数相等的氢原子符号: |
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A. Na2O与Na2O2所含化学键的类型完全相同 B. NaHSO4溶于水只需要克服离子键 C. 碘晶体受热转变成碘蒸气,克服了共价键和分子间作用力 D. 晶体熔沸点由高到低的顺序为:金刚石>氯化钠>水 |
|
| 4. | 详细信息 |
|
常温下,下列各组微粒在水溶液中一定能大量共存的是 A. H+、Na+、SO42-、CH3COO- B. K+、Na+、NO3-、SO42- C. Al3+、NH4+、Br-、HCO3- D. Na+、ClO-、Cl-、SO32- |
|
| 5. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A. 0.2 mol·L-1的NaCl液中含Na+的数目为0.2NA B. 标准状况下,11.2L水中含有的水分子数目为0.5NA C. S2和S8的混合物共6.4g,所含硫原子数一定为0.2NA D. 将100mL0.1mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶体粒子的数目为0.01NA |
|
| 6. | 详细信息 |
|
下列说法正确的是 A. 2-甲基丁烷也称异丁烷 B. 光照下,1 mol CH4与4 mol Cl2发生取代反应,产物中物质的量最多的是CCl4 C. 用酸性高锰酸钾溶液除去甲烷中的乙烯杂质 D. 甲苯的结构简式为 |
|
| 7. | 详细信息 |
|
下列实验能达到实验目的的是 A. 观察铁的吸氧腐蚀 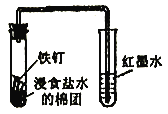 B. 石油分馏 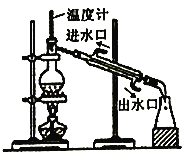 C. 制取并收集少量NO2  D. 比较氯、碳、硅元素的非金属性 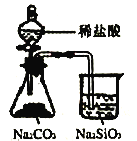 |
|
| 8. | 详细信息 |
|
甲、乙、丙三种烃分子的结构如图所示,下列有关说法正确的是 A.  的分子式为C4H4,1mol甲分子中含4mol共价键 的分子式为C4H4,1mol甲分子中含4mol共价键B. 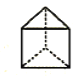 和苯互为同分异构体 和苯互为同分异构体C.  分子的二氯取代产物有两种 分子的二氯取代产物有两种D. 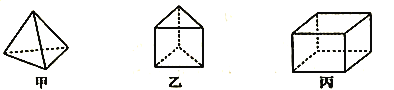 互称为同系物 互称为同系物 |
|
| 9. | 详细信息 | ||||||||||||||||||||
下列实验操作、现象和结论均正确的是
|
|||||||||||||||||||||
| 10. | 详细信息 |
|
某温度下,体积一定的密闭容器中进行如下可逆反应:3X(g)+2Y(s) A. 升高温度,正逆反应速率都增大 B. 若单位时间内每消耗3molX的同时消耗2molZ,则反应达到化学平衡状态 C. 适当增大压强,化学平衡不发生移动 D. 平衡时,X与W的物质的量浓度之比一定为3:1 |
|
| 11. | 详细信息 |
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法错误的是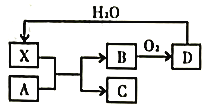 A. X使蔗糖变黑的现象主要体现了X的脱水性 B. 若A为铁,则在图中的反应,X只起氧化的作用 C. 若A为碳单质,则C不宜用来扑灭由钠引起的着火 D. 将B气体通入品红溶液中,品红溶液褪色 |
|
| 12. | 详细信息 |
|
在含Fe3+的S2O82-和I-的混合溶液中,反应S2O82-(aq)+2I-(aq)=2SO42-(aq)+I2(aq)的分解机理及反应进程中的能量变化如下: 步骤①:2Fe3+(aq)+2I-(aq)=I2(aq)+2Fe2+(aq) 步骤②:2Fe2+(aq)+S2O82-(aq)=2Fe3+(aq)+2SO42-(aq) 下列有关该反应的说法正确的是 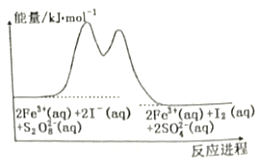 A. 化学反应速率与Fe3+浓度的大小有关 B. 该反应为吸热反应 C. Fe2+是该反应的催化剂 D. 若不加Fe3+,则正反应的活化能比逆反应的大 |
|
| 13. | 详细信息 |
一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法错误的是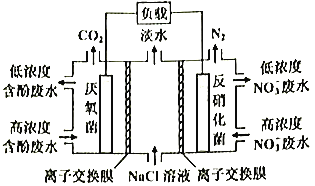 A. 左室电极为该电池的负极 B. 右室电极反应式可表示为:2NO3-+10e-+12H+=N2↑+6H2O C. 左室电极附近溶液的pH增大 D. 工作时中间室的Cl-移向左室,Na+移向右室 |
|
| 14. | 详细信息 |
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液的pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法错误的是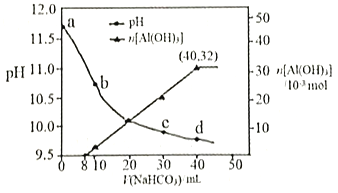 A. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-) B. 水的电离程度:a点小于c点 C. 原 NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol·L-1 D. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32- |
|
| 15. | 详细信息 |
某制糖厂以甘蔗为原料制糖,同时得到大量甘蔗渣,对甘蔗渣进行综合利用,可以提高经济效益,减少对环境的污染。如图所示为用甘蔗渣为原料制取各物质的转化过程图。 已知:①B在人体组织中发生缓慢氧化,放出热量,提供生命活动需要的能量。 ②G是具有果香气味的液体,体积分数75%的D的水溶液常用于医疗消毒,并且可以代替汽油作汽车燃料。 ③R—CHO (1)A的化学名称为___________,B的分子式为___________。 (2)E的结构简式为___________,F分子中含有的官能团的名称为___________。 (3)D+F→G的化学方程式为___________,该反应的反应类型为___________。 |
|
| 16. | 详细信息 |
|
V2-、W3-、X2+、Y2-、Z-是由短周期元素形成的简单离子,其中V2-、W3-、X2+均是10电子的微粒,Y2-、Z-与Ar原子具有相同的电子数。(请用化学用语回答下列问题) (1)V2-的结构示意图为___________。 (2)V、W、X的原子半径由小到大的顺序是______________________。 (3)无水W2H4为无色液体,在298k时与V2气体迅速反应生成W2气体和液态的V的最简单氢化物,若生成1mol该液态氢化物放出311.2kJ热量,则该反应的热化学方程式为_________________________________。 (4)YZ2是一种重要的化工产品,熔点:-78℃,沸点:59.6℃,加热至40℃以上,部分开始分解,YZ2晶体属于___________晶体。 (5)①Na2YO3溶液中离子浓度从大到小的顺序是_________________________。 ②已知:室温下H2YO3的电离平衡常数Ka1=1.4×10-2,Ka2=6.3×10-8,请通过计算确定NaHYO3水溶液的酸碱性(请写出计算过程)_________________________________。 |
|
| 17. | 详细信息 |
|
叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3的制备分两步进行,反应的化学方程式如下: i. 2Na +2NH3 实验室利用如下装置模拟工业级NaN3的制备。 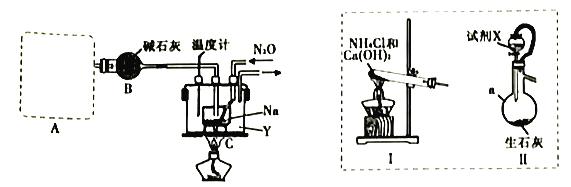 (1)装置A用于制取NH3,右图装置I和Ⅱ为气体发生装置。若选用装置I,则发生反应的化学方程式为_________________________________;若选用装置Ⅱ,则试剂X是___________(填试剂名称),仪器a的名称是___________。 (2)装置B的作用是_______________________________________________________。 (3)加热前需要先往装置C中通一段时间NH3的目的是______________________________。 (4)当观察到装置C中熔融钠单质的银白色光泽全部消失时,停止通氨气,开始通入N2O。装置C中的Y为___________(填字母)。 A.冷水浴 B.热水浴 C油浴 (5)该实验装置的缺陷是_________________________________(任写一点)。 (6)反应完全结束后,取出装置C中的混合物先后经加水、加乙醇、过滤、洗涤、干燥等操作得到NaN3固体,其中洗涤操作可用乙醚洗涤NaN3固体的原因___________。 (7)实验室用滴定法测定叠氮化钠产品中NaN3的质量分数: 操作方法:取2.500g产品配制成500.0mL溶液。取25.00mL溶液置于锥形瓶中,加入25.00mL0.1010mol·L-1(NH4)Ce(NO3)6溶液。充分反应后,稍稀释,加入4mL浓硫酸,滴入邻菲罗啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗(NH4)2Fe(SO4)2标准溶液的体积为14.80mL。 测定过程发生反应的方程式为: 2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑ Ce4++Fe2+=Ce3++Fe3+。 产品中NaN3的质量分数为___________%(保留1位小数)。 |
|
| 18. | 详细信息 | ||||||||||||
“变废为宝”是化工的重要主题。工业上可用电子工业中刻蚀线路板的酸性废液(主要成分有CuCl2,FeCl2等)制备碱式碳酸铜Cu2(OH)2CO3],其制备过程如下图所示: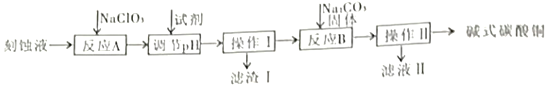 查阅资料得知,一定浓度的Cu2+、Fe2+、Fe3+生成氢氧化物沉淀的pH如下表:
|
|||||||||||||
| 19. | 详细信息 |
|
二氧化碳的有效回收利用,既能够缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。请回答下列问题: (1)CO2的电子式为___________。 (2)Zn/ZnO热化学循环还原CO2制CO的原理如下图: 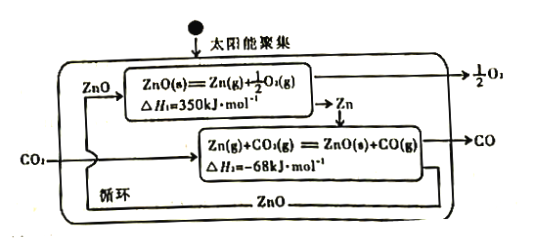 ①从循环结果看,能量转化的主要方式是_________________________________。 ②反应2CO2(g)=2 CO(g) +O2(g) △H=___________kJ·mol-1。 (3)二甲醚是重要的有机中间体,在一定条件下利用CO2与H2可直接合成二甲醚: 2CO2(g)+6H2(B) 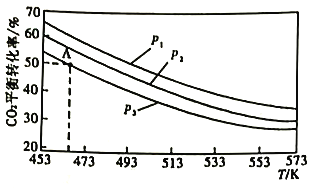 ①该反应的△H___________0(填“>”或“<")。 ②上图中的压强(p)由大到小的顺序为___________。 ③若在1L密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率对应上图中的A点,则在此温度下,该反应的化学平衡常数为___________(保留整数)。 ④合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示。  图中A点和B点的化学平衡常数比较:KA___________KB(填“>、=、<")。根据以上两条曲线,写出其中一条变化规律:____________________________________________。 (4)利用电化学原理将H2O和CO2转化为O2和燃料(C3H8O)的实验装置如下图所示。a电极的电极反应式为_________________________________。 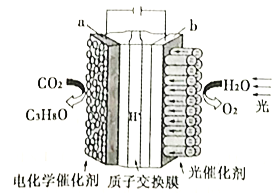 . . |
|
最近更新



