2018届高三1月月考理科综合化学考卷带参考答案和解析(山东省济南第一中学)
| 1. 选择题 | 详细信息 | |||||||||||||||
化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
|
||||||||||||||||
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( ) A. 标准状况下,22.4L的CCl4含有的CCl4分子数大于NA B. 常温下,2.7 gAl与足量浓度为18 mo1/L的浓硫酸反应时,转移的电子数为0.3NA C. 1L 2mol? L-1 CH3COONH4 溶液中含有的NH4+数目为2NA D. 1molNaHSO4 熔融时电离出的离子总数为3NA |
|
| 3. | 详细信息 |
化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )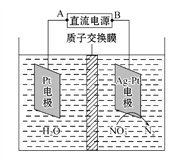 A. A为电源的正极 B. 溶液中H+从阳极向阴极迁移 C. Ag-Pt电极的电极反应式为:2NO3-+12H++10e- = N2↑+ 6H2O D. 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2 |
|
| 4. 选择题 | 详细信息 |
|
下列有关有机物的说法正确的是(? ) A. 蛋白质溶液中加Na2SO4可使其变性 B. 乙烷、苯、葡萄糖溶液均不能使酸性KMnO4溶液褪色 C. 有机物CH2=CHCH(CH3)Cl能发生加成反应、取代反应、缩聚反应、氧化反应 D. 分子式为C4H7ClO2且能与NaHCO3反应放出气体的有机物结构有5种(不包含立体异构) |
|
| 5. 选择题 | 详细信息 |
|
a、b、c、d为原子序数依次增大的短周期主族元素,a与d最外层电子数之和为12,b2?与c+的电子层结构与氖相同,c、d同周期。下列叙述正确的是 A. a的原子半径是这些元素中最小的 B. b与其他三种元素均可形成至少两种二元化合物‘ C. c与b形成的二元化合物一定只存在离子键 D. d与b、c三种元素形成的化合物的水溶液一定呈碱性 |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验操作、现象与结论对应关系正确的是( )
|
|||||||||||||||||||||
| 7. | 详细信息 |
25℃时,将浓度均为0.1mol/L 、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )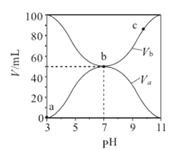 A. Ka(HA)的值与Kb(BOH)的值不相等 B. b点时,水电离出的c(H+)=10-7 mol/L C. c点时,c(A-)>c(B+) D. a→c过程中 |
|
| 8. 实验题 | 详细信息 | ||||||||
|
磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒的PH3气体(熔点为-132℃,还原性强)。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量不超过0.05mg?kg-1时,粮食质量合格;反之,粮食质量不合格。某化学兴趣小组的同学通过下列方法对粮食中残留的磷化物含量进行了研究。 【操作流程】 安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。 【实验装置】 已知 C 中盛有 100 g原粮,E 中盛有 20.00 mL 1.13×10-3 mol ?L-1KMnO4溶液(H2SO4酸化)。请回答下列问题:  (1)仪器D的名称是____________________________。 (2)B中盛有焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止氧化装置C中生成的PH3,则A中盛装KMnO4溶液的作用是_________________________。 (3)已知MnO4-被还原为Mn2+,若0.1mol PH3恰好被0.16mol KMnO4吸收,则PH3被氧化的产物是__________,写出E中发生反应的离子方程式:_________________________ (4)收集E中吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-4mol ? L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液:
|
|||||||||
| 9. 综合题 | 详细信息 | ||||||||||||
重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
|
|||||||||||||
| 10. 综合题 | 详细信息 | |||||||||
|
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为: I.C(s)+H2O(g) Ⅱ.CO(g)+H2O(g) Ⅲ.CaO(s)+CO2(g) (1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化 c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键 (2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
|
||||||||||
| 11. 推断题 | 详细信息 |
化合物E是一种医药中间体,常用于制备抗凝血药,合成路线如下: (1)A的结构简式为__________________________ ; B中含氧官能团名称为______________、_______________; (2)C转化为D的反应类型是_______________; (3)写出D与足量NaOH溶液完全反应的化学方程式___________________________。 (4)1molE最多可与________molH2加成。 (5)写出同时满足下列条件的B的一种同分异构体的结构简式 __________________; A.能发生银镜反应 B.核磁共振氢谱只有4个峰 C.能与FeCl3溶液发生显色反应,水解时1mol可消耗3molNaOH (6)已知工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯( |
|
- 高中化学人教版 必修1 第三章 金属及其化合物 2.几种重要的金属化合物 铁的重要化合物
- 黄金30题系列 高二化学 小题好拿分
- 2016-2017年高一下半期理综化学开学考试(安徽师大附中)
- 高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用
- 2017-2018年高二12月联考化学考试题(河南省豫北重点中学)
- 2016-2017年高一下半年化学开学考试专题训练(广西省桂林市第十八中学)
- 高中化学人教版 选修四 第三章 水溶液中的离子反应 第二节 水的电离和溶液的酸碱性 水的电离和溶液的酸碱性第二课时
- 2016-2017年高一上册化学期中考试考卷带参考答案和解析(山东省淄博市淄川一中)