凤阳衡水高考补习学校高三化学2019年上册月考测验在线答题
| 1. | 详细信息 |
|
下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是 A. 将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液 B. 将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液 C. 将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g) D. 将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液 |
|
| 2. | 详细信息 |
|
下列有关物质的工业用途不正确的是 A. 钠:制备过氧化钠、氯化钠等 B. 铝:制导线:用作冶炼锰、钨的原料 C. 碳酸氢钠:制发酵粉、治疗胃酸过多的胃药 D. 碳酸钠:制玻璃、制肥皂、制烧碱、造纸、纺织 |
|
| 3. | 详细信息 |
|
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是 A. 氯水的颜色呈浅绿色,说明氯水中含有Cl2 B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D. 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
|
| 4. | 详细信息 |
|
甲、乙为单质, 丙、丁为氧化物, 它们存在如图反应(反应条件省略)。下列各组的甲、乙 一定不符合的是  A. 铝和铁 B. 氟和氧 C. 碳和硅 D. 镁和碳\ |
|
| 5. | 详细信息 |
|
用NA表示阿伏伽德罗常数的值,下列叙述不正确的是( ) A. 72gCa02与KHS的混合物中含有的阴离子的数目为NA B. 足量的Mg与0.1molCO2充分反应,转移的电子数目为0.4 NA C. 25℃时,pH=2的H2S04,溶液中含有的H+数目为0.01 NA D. 标准状况下22.4 L氩气含有的质子数为18NA |
|
| 6. | 详细信息 |
|
下列关于工业生产的说法中,不正确的是 A. 工业上,用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅 B. 氯碱工业中所用的交换膜为阳离子交换膜不让氢氧根通过,防止与氯气反应造成氢氧化钠不纯。 C. 生产普通玻璃的主要原料有石灰石、石英和纯碱 D. 在高炉炼铁的反应中,焦炭为铁矿石的还原剂 |
|
| 7. | 详细信息 |
|
下列实验操作能达到实验目的的是 A. 加热使I2升华,可除去铁粉中的I2 B. 电解熔融的氯化铝,可制备铝单质 C. 加入足量氨水,充分振荡、过滤,可除去硫酸铜溶液中的硫酸铝杂质 D. 将饱和FeCl3溶液逐滴加到沸水中继续煮沸至液体呈红褐色,可制备Fe(OH)3胶体 |
|
| 8. | 详细信息 |
|
下列有关文献记载中涉及的化学知识表述不正确的是 A. “以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术 B. “墙塌压糖,去土而糖白”中的脱色过程发生了化学变化 C. “丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变 D. “煤饼烧蛎房成灰(蛎房即牡蛎壳)”中灰的主要成分为氧化钙 |
|
| 9. | 详细信息 | |||||||||||||||||||||||||
下列除杂方案错误的是
|
||||||||||||||||||||||||||
| 10. | 详细信息 |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是 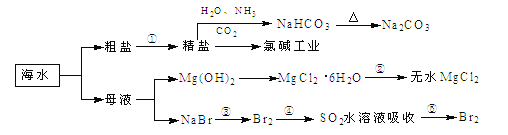 A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42- C. 在工段③、④、⑤中,溴元素均被氧化 D. 工业上通过电解饱和MgCl2溶液制取金属镁 |
|
| 11. | 详细信息 |
|
碳酸铜和碱式碳酸铜均可溶于盐酸转化为氯化铜。高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol/L盐酸500mL.灼烧等质量的上述混合物,得到氧化铜的质量是 A. 35g B. 30g C. 20g D. 15g |
|
| 12. | 详细信息 |
|
下列说法不正确的是( ) A.向Na2CO3溶液中逐滴加入HCl,直到不再生成CO2气体为止,在此过程中.溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计) B.向NaHCO3溶液中加入Ba(OH)2固体,CO32-的浓度变化是先变大后变小(溶液体积变化均忽略不计) C.有含0.2molNa2CO3和含0.3molHCl的两种溶液:①将Na2CO3溶液逐滴滴入HCl溶液中;②将HCl溶液逐滴滴入Na2CO3溶液中,①②两种操作生成的CO2体积之比为3:2 D.将等质量的Na2O和Na2O2样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b |
|
| 13. | 详细信息 | ||||||||||||||||||||
下列实验对应的现象及结论均正确且两者具有因果关系的是
|
|||||||||||||||||||||
| 14. | 详细信息 |
.某同学利用下列实验探究金属铝与铜盐溶液反应: 下列说法正确的是 A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜 B. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因 C. 实验2中生成红色物质的离子方程式:Al+Cu2+→Al3++Cu D. 由上述实验可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol/L的盐酸和硫酸反应,后者更剧烈 |
|
| 15. | 详细信息 |
为了探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及现象如图所示,结合实验现象判断该同学得出的下列结论中正确的是  A. 向滤液中滴加盐酸的实验现象是产生白色沉淀 B. 滤渣可能是两种单质的混合物 C. 滤渣在足量的稀硝酸中能完全溶解 D. 加入的金属M可能是镁或钠 |
|
| 16. | 详细信息 | |||||||||||||||
用4种溶液进行实验,下表中“溶液”与“操作及现象”对应关系错误的是 ( )
|
||||||||||||||||
| 17. | 详细信息 |
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol·L—1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是( ) A. A B. B C. C D. D |
|
| 18. | 详细信息 |
|
某白色粉末由两种物质组成,为鉴定其成分进行如下实验: ①取少量样品,加入足量水,仍有部分固体未溶解;过滤后,向所得固体中加入足量氢氧化钠溶液,固体全部溶解; ②另取少量样品加入足量氢氧化钠溶液,振荡后仍有固体存在。 该白色粉末可能为 A. Ca(HCO3)2、Al (OH)3 B. Al(OH)3、NaHCO3 C. Na2SO3、Mg(OH)2 D. Na2CO3、CuSO4 |
|
| 19. | 详细信息 |
|
2.8 g铁全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1,若反应前后溶液体积变化忽略不计,则下列有关判断正确的是 A. 反应后的溶液最多还能溶解1.4 g Fe B. 1.12 L气体可能是NO、NO2的混合气体 C. 反应后溶液中铁元素可能以Fe2+形式存在 D. 反应后溶液中c(NO3-)=0.85 mol/L |
|
| 20. | 详细信息 |
“空气吹出法”海水提漠的工艺流程如下: 下列说法中,正确的是 A. 进入吹出塔前,Br -被还原成了Br2 B. 从吹出塔进入吸收塔的物质只有Br2 C. 经过吸收塔后,溴元素得到了富集 D. 蒸馏塔中只发生了物理变化 |
|
| 21. | 详细信息 |
|
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。 Ⅰ.(1)铁元素在周期表中的位置为 _____ 。 (2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 ____ (填字母)。 a.Fe b.FeO c.Fe3O4 d.Fe2O3 Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:  回答下列问题: (1)酸浸、过滤后滤液A中的金属阳离子是 ____ 。 (2)煅烧FeCO3生成产品Ⅰ的化学方程式为______ 。 (3)写出步骤Ⅳ反应的离子方程式:______________ 。 |
|
| 22. | 详细信息 |
A、B、C均为中学化学常见的单质, 其中一种是常见金属,通常状况下,A为固体,B为深红棕色液体,C为气体,其余均为化合物,X是一种具有挥发性的无氧强酸,E为黑色晶体,H为无色液体,它们之间的转化关系如图(其中某些反应条件和产物已略去)。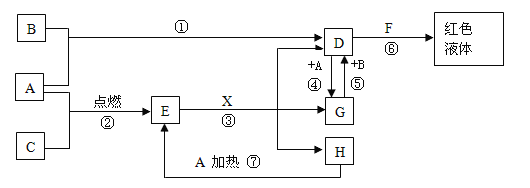 (1)在反应①~⑦中,不属于氧化还原反应的是______ (填序号)。 (2)G溶液与氯气按物质的量1∶1反应的离子方程式:________ 。 (3)反应⑦的化学方程式为 _______。 |
|
| 23. | 详细信息 |
Cl2常用作自来水消毒剂,Cl2作消毒剂时生成的有机氯化物可能对人体有害。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)。请回答下列问题: (1)A装置中反应利用了浓硫酸的难挥发性,则该反应的化学方程式为______________。 (2)当B装置中反应转移0.08 mol电子时,则消耗的Na2O2固体的质量为______________。 (3)反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为 ______________ 。 (4)ClO2的制备方法比较实用的有数十种,下列方法是常见方法之一。 方法一:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O。当有0.4 mol电子发生转移时,得到的还原产物为______________mol。 方法二:实验室常用氯酸钾(KClO3)、草酸(H2C2O4)和硫酸溶液共热制备。 有同学设计如下装置制备ClO2并用其处理含锰离子的工业废水。 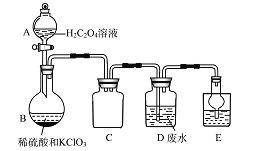 ①C装置的作用为______________。 ②B中反应产物有ClO2、CO2等, 发生氧化反应的过程为:______________ → ______________ (用化学式表示)。______________ ③写出装置D中除去Mn2+ (已知Mn2+转化为MnO2)的离子方程式:______________ 。 |
|
| 24. | 详细信息 |
|
铝硅合金材料性能优良。铝土矿(含30% SiO2、40. 8% Al2O3和少量Fe2O3等) 干法制取该合金的工艺如下: 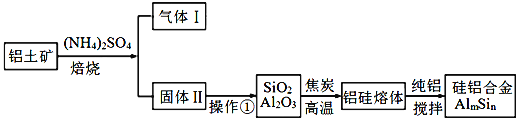  (1)焙烧除铁反应:4(NH4)2SO4+Fe2O3 (2)操作①包括:加水溶解、 过滤_______、_________。若所得溶液中加入过量NaOH溶液,含铝微粒发生反应的离子方程式为____________________ (3)用焦炭还原SiO2发生反应的化学方程式为_________________ |
|
最近更新



