新疆昌吉第九中学2021届高三上册期末考试化学题免费在线检测
| 1. 选择题 | 详细信息 |
|
化学与生产、生活密切相关,下列说法不正确的是 A. 用熟石灰可处理废水中的酸 B. 用水玻璃可生产點合剂和防火剂 C. 用食盐水有利于清除炊具上残留的油污 D. 用浸泡过高锰酿钾溶液的硅藻士保鲜水果 |
|
| 2. 选择题 | 详细信息 | ||||||||||||||||||||
下表所列物质或概念间的从属关系符合如图所示关系的是( )
|
|||||||||||||||||||||
| 3. 选择题 | 详细信息 |
下列关于各图的说法,正确的是( )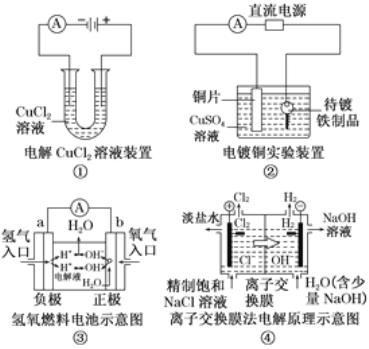 A.①中阴极处能产生使湿润淀粉_KI试纸变蓝的气体 B.②中待镀铁制品应与电源正极相连 C.③中电子由b极流向a极 D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
|
| 4. 选择题 | 详细信息 |
如图是四种常见有机物的比例模型示意图。下列说法正确的是( ) A.甲能使酸性高锰酸钾溶液褪色 B.乙可与溴水发生取代反应使溴水褪色 C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键 D.丁在稀硫酸作用下可与乙酸发生取代反应 |
|
| 5. 选择题 | 详细信息 |
|
下列各溶液中,离子的物质的量浓度关系正确的是( ) A.pH = 4 的醋酸中:c(H+) = 4.0 mol/L B.饱和小苏打溶液中:c(Na+) = c(HCO3-) C.饱和食盐水中:c(Na+) + c(H+) = c(Cl-) + c(OH-) D.pH = 12 的纯碱溶液中:c(OH-) = 1.0 × 10-12 mol/L |
|
| 6. 选择题 | 详细信息 |
某有机物的结构简式为 ,与其互为同分异构体的是 ,与其互为同分异构体的是A.  C. C. |
|
| 7. 选择题 | 详细信息 |
25 ℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( ) A.Ka(HA)=10-6 B.b点时,c(B+)=c(A-)=c(OH-) C.c点时, D.a→c过程中水的电离程度始终增大 |
|
| 8. 填空题 | 详细信息 |
在下图中,甲烧杯中盛有 (1)电源E为________极,F为________极。 (2)A极的电极反应式为____________,析出物质________ mol。 (3)B极的电极反应式为____________________,析出气体________ mL(标准状况)。 (4)C极的电极反应式为_____________,析出物质________ mol。 (5)D极的电极反应式为________,析出气体________ mL(标准状况)。 (6)甲烧杯中滴入石蕊试液,________附近变红,如果继续电解,在甲烧杯中最终得到________溶液。 |
|
| 9. 实验题 | 详细信息 |
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,其熔点为-59 ℃,沸点为11.0 ℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60 ℃时反应制得。某学生拟用图1所示装置模拟工业制取并收集ClO2。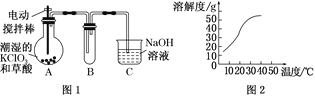 (1)A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、________。 (2)B装置必须放在冰水浴中,其原因是________________________________。 (3)反应后在装置C中可得NaClO2溶液。已知:NaClO2饱和溶液在温度低于38 ℃时析出晶体是NaClO2·3H2O,高于38 ℃时析出晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。NaClO2的溶解度曲线如图2,获得NaClO2晶体的操作步骤为: ①减压,55 ℃蒸发结晶;②趁热过滤;③____________;④在55 ℃干燥,得到成品。 (4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验: 步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样,量取V1 mL试样加入到锥形瓶中; 步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻; 步骤3:加入指示剂,用c mol·L-1Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V2 mL(已知2Na2S2O3+I2=Na2S4O6+2NaI )。 ①配制100 mL c mol·L-1Na2S2O3标准溶液时,用的玻璃仪器除烧杯、量筒、玻璃棒外还有:_____。 ②原ClO2溶液的浓度为 ____ g·L-1(用含字母的代数式表示)。 |
|
| 10. 填空题 | 详细信息 |
|
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) (1)该反应的平衡常数为________,υ(CH3OH)=______mol·L-1·min-1。若保持体积不变,再充入2molCO和1.5molCH3OH,此时υ正_______υ逆(填“>”、“<”或“=”)。 (2)在其它条件不变的情况下,再增加2molCO与5molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。 (3)下列不能说明该反应已达到平衡状态的是_________________。 a.CH3OH的质量保持不变 b.混合气体的平均相对分子质量不再改变 c.υ逆(CO)=2υ正(H2) d.混合气体的密度不再发生改变 (4)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则P1________P2(填“大于”、“小于”或“等于”,下同),△H________0,该反应在________(填“高温”或“低温”)下能自发进行。  (5)能使该反应的反应速率增大,且平衡向正反应方向移动的是_________。 a.及时分离除CH3OH气体 b.适当升高温度 c.增大H2的浓度 d.选择高效催化剂 |
|
| 11. | 详细信息 | ||||||||||||||||||||
|
C、N、O、Al、Si、Cu是常见的六种元素。 ①Si位于元素周期表第________周期第________族。 ②N的基态原子核外电子排布式为________;Cu的基态原子最外层有________个电子。 ③用“>”或“<”填空:
(2)O、Na、P、Cl四种元素中电负性最大的是________(填元素符号),其中P原子的核外电子排布式为___________________。
则该元素是________(填写元素符号)。 |
|||||||||||||||||||||
| 12. 推断题 | 详细信息 |
醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路: 已知: a B存在顺反异构 b 1mol E与足量的银氨溶液反应能生成2mol c F能与 d丁烷、  互为同分异构体的结构简式______. 互为同分异构体的结构简式______. |
|
最近更新



