湖北省宜昌市葛洲坝中学2021届高三9月月考化学题免费试卷在线检测
| 1. 选择题 | 详细信息 |
|
物质分类的依据通常有组成和性质。下列物质分类中,只考虑组成的是 A.Na2SO4是钠盐、硫酸盐、正盐 B.HNO3是一元酸、强酸、挥发性酸 C.Mg(OH)2是二元碱、难溶性碱、中强碱 D.Al2O3是两性氧化物、金属氧化物、最高价氧化物 |
|
| 2. 选择题 | 详细信息 |
在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )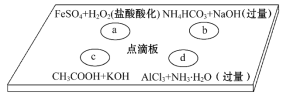 A. a反应:Fe2++2H++H2O2=Fe3++2H2O B. b反应:HCO3-+OH-=CO32-+H2O C. c反应:H++OH-=H2O D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
|
| 3. 选择题 | 详细信息 |
|
室温下,下列各组离子在指定溶液中能大量共存的是 A. 0.1 mol·L−1NaOH溶液:Na+、K+、 B. 0.1 mol·L−1FeCl2溶液:K+、Mg2+、 C. 0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH− D. 0.1 mol·L−1H2SO4溶液:K+、 |
|
| 4. 选择题 | 详细信息 |
|
下列离子的检验方法合理的是( ) A.向某溶液中滴入硫氰酸钾溶液呈红色,说明不含Fe2+ B.向某溶液中通入氯气,然后再加入硫氰酸钾溶液变红色,说明原溶液中含有Fe2+ C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+ D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+ |
|
| 5. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法正确的是 A. 常温常压下,124 g P4中所含P—P键数目为4NA B. 100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA |
|
| 6. 选择题 | 详细信息 |
|
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( ) A.称量物错放在托盘天平右盘 B.定容时观察液面俯视 C.有少量NaOH溶液残留在烧杯中 D.容量瓶中原来有少量蒸馏水 |
|
| 7. 选择题 | 详细信息 |
|
下列溶液中能够区别SO2和CO2气体的是( ) ①石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液 A.①②③ B.②③④ C.②③④⑤ D.全部 |
|
| 8. 选择题 | 详细信息 |
|
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是 A.NaClO溶液的消毒原理是使蛋白质变性 B.1molCl2与足量NaOH溶液反应转移2mol电子 C.NaClO溶液的漂白原理与Na2O2、SO2相同 D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果 |
|
| 9. 选择题 | 详细信息 |
某化学兴趣小组利用MnO2和浓盐酸及如图制备Cl2。下列不正确的是( )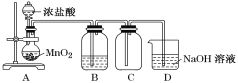 A.A中不能用长颈漏斗代替分液漏斗 B.A中缺少加热装置 C.B中盛放NaOH溶液净化Cl2 D.D中的导管口若连接倒置漏斗可防止倒吸 |
|
| 10. 选择题 | 详细信息 |
从淡化海水中提取溴的流程如下: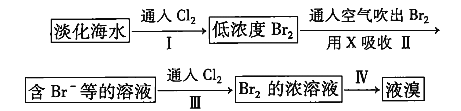 下列有关说法不正确的是( ) A.X可用 B.步骤Ⅲ发生的离子反应为 C.工业上每获得1 mol D.步骤Ⅳ涉及的操作有萃取、分液和蒸馏 |
|
| 11. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能 B.因为CaCO3+SiO2 C.CO2和SiO2都能与碳反应,且都作氧化剂 D.SiO2既能和NaOH反应,又能和氢氟酸反应,但SiO2不属于两性氧化物 |
|
| 12. 选择题 | 详细信息 |
|
臭氧(O3)可应用于游泳池、生活用水、污水的杀菌和消毒,大气中的臭氧层能有效阻挡紫外线。长期吸入大量臭氧会引起口干舌燥、咳嗽等不适症状。臭氧发生器是在高压电极的作用下将空气中的氧气转化为臭氧的装置。下列说法正确的是( ) A.氧气转化为臭氧是化学变化 B.臭氧(O3)的摩尔质量为48g C.氮氧化合物会导致臭氧层空洞 D.臭氧对人的身体健康不利,应该拒绝使用臭氧 |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||
根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
|
|||||||||||||||||||||
| 14. 选择题 | 详细信息 |
Cl2O是黄棕色有刺激性气味的气体,是一种强氧化剂,易溶于水且与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。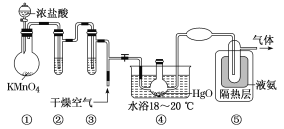 已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2=HgCl2+Cl2O。下列说法中正确的是( ) A.装置②③中盛装的试剂依次是饱和食盐水和浓硫酸 B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险 C.从装置⑤中逸出气体的主要成分是Cl2O D.装置④与⑤之间如果用橡胶管连接,不会导致橡胶管燃烧并爆炸 |
|
| 15. 选择题 | 详细信息 |
浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是( ) A.对比①和②可以说明还原性:Br->Cl- B.①和③相比可说明氧化性:Br2>SO2 C.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HCl D.③中的反应是非氧化还原反应 |
|
| 16. 实验题 | 详细信息 |
|
实验室欲配制0.1 mol / L的NaOH溶液350 mL,回答下列问题: (1)配制时必须使用的仪器除天平(带砝码)、烧杯、玻璃棒 ____________________; A.胶头滴管 B.350mL容量瓶 C.500mL容量瓶 D.容量瓶 (2)玻璃棒的作用_________________; (3)用托盘天平称量所需要NaOH的质量为__________g; (4)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨装瓶贴签。其正确的操作顺序为 ______________ ; A、②①③⑧⑤⑥⑦④⑨ B、①②⑦③⑤⑥④⑧⑨ C、②①③⑤⑥⑦④⑨⑧ (5)下列操作会使所配制溶液浓度偏大的有_______。 A、溶解固体溶质时,未冷却至室温即转入容量瓶进行定容 B、定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线 C、容量瓶中原有少量蒸馏水 D、定容时观察液面仰视 (6)配制好的NaOH溶液不能用带磨口玻璃塞的试剂瓶存放,请用化学方程式解释原因__________________________。 |
|
| 17. | 详细信息 | ||||||||||||
为了充分利用资源,某实验小组设计的利用工业生产中的锌锰废料(主要含ZnO、MnO2,还含少量铁的氧化物和不溶于酸的杂质)制备ZnSO4·7H2O粗品和KMnO4粗品的实验流程如图1所示。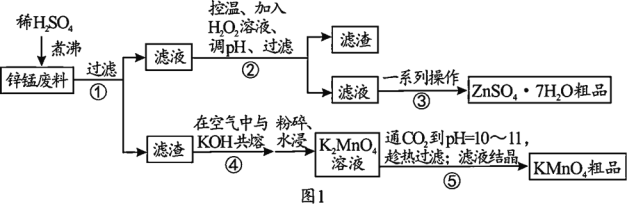 资料①3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3。②常温下,相关物质的溶解度数据见下表。
|
|||||||||||||
| 18. 实验题 | 详细信息 |
工业以浓缩海水为原料提取溴的部分过程如下: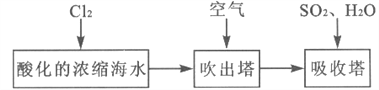 某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去): 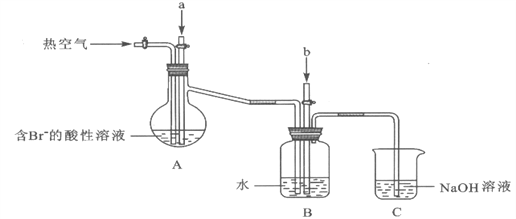 (1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_________。 (2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是_________。 (3)反应过程中,B装置中Br2与SO2反应的化学方程式____________________。 (4)C装置的作用是___________________。 (5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。 ①一位同学根据溴的沸点是59℃,提出采用____________________方法从该混合液中分离出溴单质。 ②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是________。 (6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由: _______。 |
|
| 19. | 详细信息 |
水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝等金属氧化物。实验室测定水泥样品中钙含量的过程如图所示: 回答下列问题: (1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是________________________________ (2)沉淀A的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为__________________________________________________________。 (3)加氨水过程中加热的目的是__________________________________。沉淀B的主要成分为________________、________________(写化学式)。 |
|
| 20. 实验题 | 详细信息 |
某学习小组设计实验探究NO与铜粉的反应,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的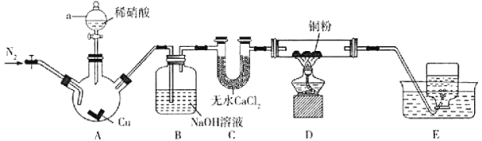 (1)实验开始前通入 (2)装置A中发生反应的离子方程式为_______________________。 (3)装置B中NaOH溶液的作用是___________________。 (4)装置D中有______________________现象,即可证明NO与Cu发生反应。 (5)利用NO可制得 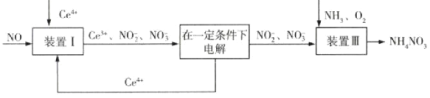 已知进入装置Ⅲ溶液中的 |
|
高中化学 试卷推荐
最近更新