2020年河南省南阳市邓州市中考一模化学考试
| 1. | 详细信息 |
|
下列生活中常见的变化属于物理变化的是 A.葡萄酿酒 B.冰雪融化 C.食物腐烂 D.烧制陶瓷 |
|
| 2. | 详细信息 |
|
“绿水青山就是金山银山”,坚持人与自然和谐共生生是新时代我国发展的基本方略之一。下列做法正确的是( ) A. 就地燃烧秸秆,增加土壤肥力 B. 大力挖山开矿,帮助农民脱贫 C. 因地制宜,发展特色乡村旅游 D. 大量使用化肥,植树造林绿化荒山 |
|
| 3. | 详细信息 |
|
构成下列物质的微粒与构成干冰的微粒种类相同的是 A. 铜 B. 液氧 C. 金刚石 D. 氯化钠 |
|
| 4. | 详细信息 |
下列实验操作符合安全要求的是 |
|
| 5. | 详细信息 |
|
下列排序正确的是 A.空气中物质含量: B.溶液pH: C.金属活动性顺序: D.硫元素质量分数: |
|
| 6. | 详细信息 |
如图是硒元素的原子结构示意图,有关说法不正确的是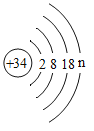 A.n的值为4 B.Se在第四周期 C.Se的质子数是34 D.Se是非金属元素 |
|
| 7. | 详细信息 |
|
下列有关水的说法正确的是 A.澄清洁净的矿泉水是纯水 B.水电解时生成氢气和氧气的质量比为2∶1 C.将硬水过滤可以得到软水 D.净水的方法有沉淀、过滤、吸附和蒸馏等 |
|
| 8. | 详细信息 |
|
将足量铁钉放人硫酸铜溶液中,铁钉表面有红色物质析出,且产生少量无色无味的气体。下列说法正确的是 A.硫酸铜溶液可能呈酸性 B.气体可能是二氧化硫 C.反应后溶液呈黄色 D.反应后固体的质量小于反应前固体的质量 |
|
| 9. | 详细信息 |
|
误差分析是定量实验的一个重要内容,下列分析正确的是 A.用量筒量取10mL水,仰视读数会导致水的实际体积偏小 B.测定溶液的pH,先用水将pH试纸润湿,会导致测出的pH偏大 C.用红磷燃烧测定空气中氧气的体积分数,红磷的量不足会导致结果偏小 D.配制溶质量分数为6%的氯化钠溶液,氯化钠中含有杂质会导致氯化钠的质量分数偏大 |
|
| 10. | 详细信息 |
|
下列鉴别物质所用的方法不正确的是 A.碳酸钙与氯化钙----------加水溶解 B.氢氧化钠和氯化钠----------加水溶解 C.硝酸铵与氯化铵----------加熟石灰研磨 D.羊毛纤维和腈纶纤维----------灼烧、闻气味 |
|
| 11. | 详细信息 |
用“ A. 该反应属于化合反应 B. 反应的生成物是混合物 C. 反应后各元素化合价都发生了改变 D. 参加反应的A2与B2的分子个数比为3:1 |
|
| 12. | 详细信息 |
已知:Na2CO3+H2O+CO2=2NaHCO3。将二氧化碳气体缓缓通入到一定质量的Na2CO3溶液中,测得变量y随时间的变化趋势如图所示。变量y可表示的是 A.溶剂的质量 B.溶液中碳元素的质量 C.碳酸钠的质量分数 D.溶液中钠元素的质量 |
|
| 13. | 详细信息 |
|
将共1.2g镁和氧化镁的混合物加人50g稀盐酸中恰好完全反应,则稀盐酸的质量分数不可能为 A.5.1% B.6.5% C.7.1% D.7.3% |
|
| 14. | 详细信息 |
| 空气中体积分数约为21 %的气体是______________,人体中含量最多的金属元素所形成的氧化物的化学式________________________。 | |
| 15. | 详细信息 |
| 乙醇完全燃烧的化学方程式为__________________;成语“釜底抽薪”中所依据的灭火原理是____________;氢气作为未来新能源,目前存在的困难是_________________(答出一条即可)。 | |
| 16. | 详细信息 |
| 某种洗衣机的构件中有塑料面板、电动机、铝导线和铁螺丝钉等。其中塑料面板的制作材料属于______( 填“合金”或“合成材料”);铝作导线是利用了金属的延展性和_____________性;铁螺丝钉生锈主要是铁与空气中的_____________反应的结果。 | |
| 17. | 详细信息 |
如图是甲、乙两种固体物质的溶解度曲线。能使乙的不饱和溶液变成饱和溶液的一种方法是______;t1℃时,相同质量的甲、乙分别配成饱和溶液,需加水的质量为甲___乙(填“ <”“>”“=”);t3℃时,将质量为x的甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为25%,则x=___________。 |
|
| 18. | 详细信息 |
| 质量相等的CO、CH4、H2完全燃烧需要氧气的质量由多到少的顺序为______________。托盘天平两边各放一个烧杯,其中分别装入足量的、等质量、等溶质质量分数的稀盐酸,此时天平平衡,将一定质量金属镁、铝分别加入两烧杯中,充分反应后天平仍然平衡,则加入的金属镁、铝的质量比为____________。 | |
| 19. | 详细信息 |
A、B、C、D、E是不同种类的物质,它们的转化关系如图所示 (部分物质和反应条件已略去)。A是年产量最高的金属,B中氧元素占30%,D (常用于配制农药波尔多液。则B→A的化学方程式为___;E的化学式为_______________。B与C反应的化学方程式为_______________。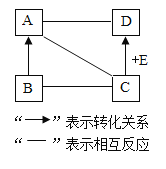 |
|
| 20. | 详细信息 |
|
从微观角度看问题是化学学科的独特视角。请从微观角度回答下列问题: (1)液氧转化为氧气的过程中,发生变化的是什么?________________ (2)以石墨为原料生产人造金刚石过程中,从原子的角度分析发生改变的是什么?_____________ |
|
| 21. | 详细信息 |
已知图1中甲、乙、丙含有相同的某种元素,乙、丙为氧化物,且常温下丙为液态。 (1)写出实验室用图2中装置B制取甲的化学方程式________________________。 (2)写出一个有丙参与的化合反应________________________。 (3)已知某气体密度与空气接近且难溶于水,请在C图中补画完整该气体收集装置图并用箭头标明进气端________。 |
|
| 22. | 详细信息 |
如图一所示,三个充满CO2气体的烧瓶,注射器内各装有85mL的液体(分别是水、饱和石灰水、40%的氢氧化钠溶液)。同时将注射器内液体注入烧瓶中,关闭活塞。观察到烧瓶内气压变化图像如图二所示。 (1)曲线2发生反应的化学方程式为_________________________________。 (2)通过上述三条曲线的对比可得出除去CO2气体应选择的试剂是__________________。 (3)请设计实验证明曲线3反应后溶液中可能所含的溶质,简要写出步骤和现象)_________________。 |
|
| 23. | 详细信息 |
用稀盐酸中和一定量氢氧化钙溶液时,溶液的pH与加入的稀盐酸质量的关系如图所示。 (1)请写出该反应的化学方程式________。 (2)若向c点溶液中逐滴滴加足量碳酸钠溶液,可观察到什么现象?_______ |
|
| 24. | 详细信息 |
|
化学实验是科学探究的重要手段。金属及化合物是工农业生产及日常生活中应用广泛的物质。 (1)某化学小组用长柄V型玻璃管进行实验,向左右两端的V型玻璃管口分别同时滴入等量的浓氨水和浓盐酸,塞紧橡皮塞。一段时间后,观察到有白烟产生,且白烟位置偏右,由此可说明__________________。(用微粒观点答题,已知生成白烟发生反应的化学方程式为 (2)金属铝既可以与酸反应,又可以与碱反应,铝与NaOH溶液反应生成NaAlO2和H2。写出反应的化学方程式:__________________________________。 (3)某化学小组在Al(NO3)3、Cu( NO3)2和AgNO3的混合溶液甲中加入一定量的锌粉,充分反应后过滤,得到固体乙和溶液丙,且溶液甲和溶液丙的质量相等。  ①写出一个有关反应的化学方程式_______________________________。 ②写出溶液丙中一定含有的金属离子(写化学符号) _______________________________。 ③若液体丙为蓝色,向固体乙上滴加盐酸______________(填“一定有”“可能有”或“一定没有”)气泡产生。 (4)粗盐的主要成分是NaCl,下面是除去粗盐中MgCl2、Na2SO4、CaCl2等杂质的流程图。(提示:微溶物不形成沉淀)  a.写出操作②中发生的化学方程式(写出一个即可) ________________。 b.写出加入过量Na2CO3溶液的目的________________。 (5)钛和钛合金性能优良,广泛用于航空、造船和化学工业中。工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛。若要用该方法制取1.2kg钛,理论上需要钠的质量是多少?___________ |
|
最近更新



