河南高三化学期末考试(2019年上期)带答案与解析
| 1. 选择题 | 详细信息 |
|
下列说法不正确的是( ) A. 硝化甘油在体内能够分解出大量硝酸,会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛 B. 侯氏制碱法的工艺流程应用了物质溶解度的差异 C. 刚玉、红宝石、蓝宝石的主要成分是氧化铝,而青花瓷、玻璃、分子筛的主要成分是硅酸盐 D. 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单 |
|
| 2. 选择题 | 详细信息 | |||||||||||||||
下列实验对应的解释或结论正确的是
|
||||||||||||||||
| 3. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述错误的是( ) A. 17gH2O2所含非极性键数目为0.5NA B. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA C. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA D. 100gCaS和CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA |
|
| 4. 选择题 | 详细信息 |
下列是三种有机物的结构简式,下列说法正确的是( )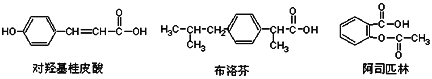 A. 三种有机物都能发生水解反应 B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 C. 三种物质中,其中有两种互为同分异构体 D. 三种物质在一定条件下,均可以被氧化 |
|
| 5. 选择题 | 详细信息 |
|
短期主族元素A、B、C、D原子序数依次增大。已知:A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是 ( ) A. 原子半径:A<B<C<D B. B的氧化物是酸性氧化物,可溶于氨水 C. D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性 D. 四氧化三铁与B的反应是工业上大量生产铁的重要方法 |
|
| 6. 选择题 | 详细信息 |
|
银一 Ferrozine法检测甲醛(HCHO)的原理为①在原电池装置中,氧化银能将甲醛充分氧化为CO2;②Fe3+与产生的Ag定量反应生成Fe2+;③Fe2+与 ferrozine形成有色配合物;④测定溶液的吸光度(吸光度与溶液中有色物质的浓度成正比)。下列说法正确的是 A. ①中,负极的电极反应式为2Ag2O+4H++4e-====4Ag+2H2O B. ①中,溶液中的H+由正极移向负极 C. 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4 D. ④中,甲醛浓度越大,吸光度越小 |
|
| 7. 实验题 | 详细信息 |
|
氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。 Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。 (1)请用最常见的试剂和简单操作设计实验证明N、C元素的非金属性强弱:__________________(只说明操作及现象)。 (2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是___________________________。 Ⅱ.工业制备过硫酸钠的反应原理如下: 主反应:(NH4)2S2O8+2NaOH 副反应:2NH3+3Na2S2O8+6NaOH 某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。 (实验一)实验室通过如图所示装置制备Na2S2O8。  (3)欲控制通入O2的通入速率,采取的有效措施为____________________(答一条) (4)装置a中反应产生的气体需要持续通入装置c的原因是____________________。 (5)上述装置中还需补充的实验仪器或装置有_______(填字母)。 A.温度计 B.洗气瓶 C.水浴装置 D.酒精灯 (实验二)测定用过硫酸钠溶液处理后的废水中氰化钠的含量。 已知:①废水中氰化钠的最高排放标准为0.50 mg·L-1。 ②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI (6)滴定终点的现象是________________________________________。 (7)处理后的废水中氰化钠的浓度为________mg·L-1。(保留3位有效数字) |
|
| 8. | 详细信息 |
铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。 已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似 Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10 (1)滤液A的主要成分除NaOH外,还有______________ (填化学式), 写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________。 (2)溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序___________。 a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水 d.加入适量的HCl e.过滤 f.洗涤 (3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。 ②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。 (4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是________________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。 |
|
| 9. 综合题 | 详细信息 | |||||||||||||||
|
研究碳、氮及其化合物的转化对于环境的改善有重大意义。 (1)氧化还原法消除NOx的转化如下:NO 已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1 2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1 则反应Ⅰ的热化学方程式为_____________________________________________。 (2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ΔH>0,请你分析该设想能否实现并说明理由是____________________________________________。 (3)甲酸的电离平衡常数Ka=1.70×10-4。向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为______________________。 (4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
|
||||||||||||||||
| 10. 填空题 | 详细信息 |
|
铜、磷及其化合物是非常重要的物质。 (1)Cu+的电子排布式____; (2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个; (3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____; (4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____; (5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。 |
|
| 11. 推断题 | 详细信息 |
醋硝香豆素是一种洽疗心脑血管疾病的药物,能阻碍血栓扩展。醋硝香豆素可以通过以下方法合成(部分反应条件已省略)。 请回答下列问题: (1)A的名称是___________;醋硝香豆素中所含官能团的名称为___________。 (2)反应①的反应类型是___________;反应⑤的反应类型为___________。 (3)C的结构简式为___________;反应④的化学方程式为______________________。 (4)关于E物质下列说法正确的是___________(填字母) a.可以用酸性高锰酸钾溶液鉴别D和E b.在核磁共振氢谱中有五组吸收峰 c存在顺反异构 d可以发生加成反应、聚合反应、氧化反应和消去反应 (5)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有___________种 ①可与氯化铁溶液发生显色反应;②可与碳酸氢钠溶液反应生成二氧化碳气体。 其中,苯环上的一氯代物只有两种的结构简式为___________。区分上述G的各种同分异构体可选用的仪器是___________(填字母) a.元素分析仪 b.红外光谱仪 c.核磁共振仪 |
|
最近更新



