吉林高二化学期中考试(2019年上半年)完整试卷
| 1. 选择题 | 详细信息 |
|
下列指定化学用语正确的是( ) A. NaHCO3 水解的离子方程式:HCO3-+H2O = CO32-+H3O+ B. Ba(OH)2的电离方程式:Ba(OH)2 C. NaHSO4在水中的电离方程式:NaHSO4 = Na++H++SO42- D. Na2S水解的离子方程式:S2-+2H2O = H2S+2OH- |
|
| 2. 选择题 | 详细信息 |
|
甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( ) A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来H+的物质的量浓度的10倍 B.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙) C.物质的量浓度c(甲)>10c(乙) D.甲中的c(OH-)为乙中的c(OH-)的10倍 |
|
| 3. 选择题 | 详细信息 |
|
用标准浓度氢氧化钠的溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( ) ①碱式滴定管用蒸馏水洗净后未用标准溶液润洗 ②锥形瓶中盛有少量蒸馏水,再加待测液 ③酸式滴定用蒸馏水洗净后,未用盐酸润洗 ④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失 ⑤滴定后观察碱式滴定管读数时,视线高于刻度线 A.①④ B.①③ C.②③ D.④⑤ |
|
| 4. 选择题 | 详细信息 |
|
下列说法正确的是 A. 常温下,pH=4的CH3COOH溶液中,由水电离的c(H+) = 10-10 mol/L B. 将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3 C. 0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O) D. 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2- |
|
| 5. 选择题 | 详细信息 |
|
下列事实: ①NaHSO4溶液呈酸性;②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结;③配制CuCl2溶液,用稀盐酸溶解CuCl2固体;④NaHS溶液中c(H2S)>c(S2-);⑤氯化铵溶液可去除金属制品表面的锈斑;⑥加热FeCl3·6H2O晶体,往往得不到FeCl3固体。 其中与盐类的水解有关的叙述有( ) A. 6项 B. 5项 C. 3项 D. 4项 |
|
| 6. 选择题 | 详细信息 |
|
室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( ) A.若pH>7,则一定是c1V1=c2V2 B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) C.当pH=7时,若V1=V2,则一定是c2>c1 D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
|
| 7. 选择题 | 详细信息 |
|
在25℃时,下列有关电解质溶液的说法不正确的是( ) A.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a B.0.1mol·L-1的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3) C.1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液,前者含NH4+ 物质的量多 D.浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+) |
|
| 8. 选择题 | 详细信息 |
常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是 A.a点溶液中:水电离出的c(H+)=1×10-12mol/L B.b点溶液中:c(H+)=1×10-7mol/L C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-) |
|
| 9. 选择题 | 详细信息 |
某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:lg2=0.3,Ksp(ZnS)=3×10-25 。下列有关说法正确的是( )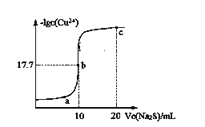 A.a、b、c三点中,水的电离程度最大的为b点 B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) C.该温度下Ksp(CuS)=4×10-36 D.向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Zn2+先沉淀 |
|
| 10. 选择题 | 详细信息 |
|
下列关于金属腐蚀与防护的说法错误的是 A.当镀锡铁制品的镀层破损时,镀层不再对铁制品起保护作用 B.在空气与水面交接处的钢柱,比在水下部分的钢柱容易腐蚀 C.钢铁不论发生析氢腐蚀还时吸氧腐蚀,其负极反应都为Fe-2e-=Fe2+ D.将输油管道与电源的正极相连的防护方法叫做牺牲阳极的阴极保护法 |
|
| 11. 选择题 | 详细信息 |
|
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( ) A.由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-=Cu2+ B.由Al、Cu、稀硫酸组成原电池,负极反应式为:Cu-2e-=Cu2+ C.由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-=AlO2-+2H2O D.由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Al-3e-=Al3+ |
|
| 12. 选择题 | 详细信息 |
|
铅蓄电池放电时的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列判断错误的是 A. 放电时Pb为负极 B. 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- C. 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极 D. 用铅蓄电池电解CuCl2溶液,若制得2.24L Cl2(标准状况),这时电池内至少转移0.2 mol电子 |
|
| 13. 选择题 | 详细信息 |
|
200mL NaNO3和Cu(NO3)2的混合溶液中c(NO3-)=1.4mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体2.24L(标准状况下),假定电解后溶液体积仍为200 mL,下列说法正确的是 A. 原混合溶液中c(Na+)=0.9 mol·L-1 B. 电解后溶液的pH值为0 C. 上述电解过程中共转移0.8 mol电子 D. 电解后得到的Cu的物质的量为0.2mol |
|
| 14. 选择题 | 详细信息 |
电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2,以下说法正确的是( ) A. a极与电源的负极相连 B. 产物丙为硫酸 C. 离子交换膜d为阴离子交换膜 D. a电极反应式:2H2O+2e-===H2↑+2OH- |
|
| 15. 选择题 | 详细信息 |
用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( ) A.燃料电池工作时负极反应为:H2=2H++2e- B.若要实现铁上镀铜,则a极是铁,b极是铜 C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出 D.a、b两极均是石墨时,在相同条件下,当电池中消耗H222.4L(标准状况)时,a极析出铜64g |
|
| 16. 选择题 | 详细信息 |
在如图串联装置中,通电片刻即发现乙装置左侧电极表面出现红色固体,则下列说法不正确的是( ) A.标准状况下当甲中产生4.48L气体时,丙中Cu电极质量增加21.6g B.电解过程中丙中溶液pH无变化 C.向甲中加入适量的盐酸,可使溶液恢复到电解前的状态 D.乙中左侧电极反应式:Cu2++2e-=Cu |
|
| 17. 选择题 | 详细信息 |
我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na A. 放电时,ClO4-向负极移动 B. 充电时释放CO2,放电时吸收CO2 C. 放电时,正极反应为:3CO2+4e− =2CO32-+C D. 充电时,正极反应为:Na++e−=Na |
|
| 18. 选择题 | 详细信息 |
工业废气H2S经资源化利用后可回收能量并得到单.质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( ) A. 电极a为电池的负极 B. 电极b上的电极反应式为:O2+4H++4e-=2H2O C. 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 D. 若电路中通过2mol电子,则电池内部释放632kJ热能 |
|
| 19. 选择题 | 详细信息 |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。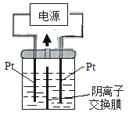 已知:3I2+6OH—=IO3—+5I—+3H2O 下列说法不正确的是 A. 右侧发生的电极方程式:2H2O+2e—=H2↑+2OH— B. 电解结束时,右侧溶液中含有IO3— C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑ D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
|
| 20. 综合题 | 详细信息 |
|
(1)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH____NaOH溶液的pH(填“>”“=”或“<”)。 (2)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积___氨水的体积(填“>”“=”或“<”)。 (3)将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则: ①混合溶液中,c(A-)________c(HA)(填“>”“<”或“=”,下同); ②混合溶液中,c(HA)+c(A-)________0.1 mol·L-1。 (4)常温时,取0.1 mol·L-1HX溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液的pH=8。 ①混合溶液中由水电离出的c(OH-)与0.1 mol·L-1NaOH溶液中由水电离出的c(OH-)之比为________。 ②已知NH4X溶液呈中性,又知将HX溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH____7(填“>”“<”或“=”)。 |
|
| 21. 实验题 | 详细信息 | ||||||||||||
|
“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5 ①取250 mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管中在170 ℃下充分反应; ②用水一乙醇液充分溶解产物I2,配制100 mL溶液; ③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。消耗标准Na2S2O3溶液的体积如表所示。
|
|||||||||||||
| 22. 综合题 | 详细信息 |
|
某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- (1)NaHB溶液显___(填“酸性”、“中性”或“碱性”或“无法确定”),理由是_______。 (2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填序号)。 a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-) c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1 (3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是________0.11 mol·L-1(填“<”、“>”或“=”); 理由是__________。 |
|
| 23. 填空题 | 详细信息 |
|
某实验小组同学对电化学原理进行了一系列探究活动。 (1)如图为某实验小组依据氧化还原反应_______________(用离子方程式表示)设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差 12 g,导线中通过__________mol 电子。  (2)其他条件不变,若将 CuCl2溶液换为 NH4Cl 溶液,石墨电极发生的电极反应为___________,这是由于 NH4Cl 溶液显_______________(填“酸性”、“碱性” 或“中性”)。用吸管吸出铁片附近的溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴 KSCN 溶液,溶液变红,继续滴加过量新制饱和氯水,溶液颜色褪去,同学们对此做了多种假设,某同学的假设:“溶液中的+3 价铁被氧化为更高价态。” 如果+3 价铁被氧化为 FeO42-,写出发生反应的离子方程式___________________。 (3)其他条件不变,若将盐桥换成弯铜导线与石墨连成的形装置如图所示,一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是____________,电极反应为__________;乙装置中石墨(Ⅰ)为__________(填“正”、 “ 负” 、 “ 阴”或“阳”)极。 |
|
| 24. 填空题 | 详细信息 |
如图所示,某同学设计一个甲醚燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。 根据要求回答相关问题: (1)写出负极的电极反应式_____________________________。 (2)铁电极为________(填“阳极”或“阴极”),石墨电极(C)的电极反应式为________________。 (3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____(填“增大”、“ 减小”或“不变”)。 (4)若在标准状况下,有2.24L氧气参加反应,则丙装置中阴极析出铜的质量为______。假设乙装置中氯化钠溶液足够多,若在标准状况下,有224mL氧气参加反应,则乙装置中阳离子交换膜左侧溶液质量将____________(填“增大”、“减小”或“不变”),且变化了_______克。 (5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为_________________________________。 |
|
高中化学 试卷推荐
- 2017-2018年高二上半年第二次月考化学考题带答案和解析(福建省莆田九中)
- 2018届高三上学期第五次月考理科综合-化学试卷(江西省南昌市第二中学)
- 2017-2018年高一上学期第二次阶段性检测化学考题带答案和解析(湖南省长沙市第一中学)
- 2017-2018年高一上学期第二次月考化学考题带答案和解析(河南省商丘市第一高级中学)
- 2017届高一上第三次月考化学试卷(安徽省淮北一中)
- 高中化学人教版 选修三 第3章 晶体结构与性质 金属晶体的原子堆积模型
- 2017-2018年高二12月月考化学考卷带参考答案和解析(安徽省铜陵市第一中学)
- 2017,2018年高中化学新人教版必修二 第一章物质结构元素周期律1.2.2元素周期表和元素周期律的应用
最近更新