安徽省合肥市第十中学2021届高三第三次阶段检测化学在线考试题免费练习
| 1. 选择题 | 详细信息 |
|
化学与生活密切相关,下列说法正确的是( ) A.使用填埋法处理未经分类的生活垃圾 B.用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 C.向鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯 D.CO2、NO2或SO2的排放是形成酸雨的主要原因 |
|
| 2. 选择题 | 详细信息 |
|
下列化学用语对事实的表述正确的是 A.常温下,0.1mol·L-1 氨水的 pH=11: NH3·H2O ⇌ NH4+ + OH- B.Mg 和 Cl 形成离子键的过程: 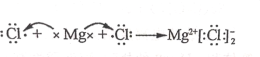 C.电解 CuCl2 溶液: CuCl2 == Cu2+ + 2Cl- D.乙酸与乙醇发生酯化反应: CH3COOH + C2H518OH |
|
| 3. 选择题 | 详细信息 |
|
NA 代表阿伏加德罗常数的值,下列叙述正确的是 A.常温常压下,1.8g 甲基(—CD3)中含有的中子数目为 NA B.0.5mol 雄黄(As4S4,结构为 C.pH=1 的尿酸(HUr)溶液中,含有 0.1NA 个 H+ D.标准状况下,2.24 L 丙烷含有的共价键数目为 NA |
|
| 4. 选择题 | 详细信息 |
|
下列对实验现象解释的方程式中,正确的是( ) A.向醋酸中加入小苏打溶液,产生无色气体: B.向 C.向 D.向铬酸钾溶液中滴入少量浓硫酸,溶液变橙色: |
|
| 5. 选择题 | 详细信息 |
|
下列关于离子共存或离子反应的说法正确的是( ) A.某无色溶液中可能大量存在H+、NH B.pH=12的溶液中可能大量存在Na+、NH C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O D.过量的硫酸氢钠与Ba(OH)2溶液的反应:H++SO |
|
| 6. 选择题 | 详细信息 |
已知某有机物X的结构简式如图所示,下列说法正确的是( )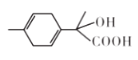 A.X属于芳香烃的含氧衍生物 B.X的分子式为 C.X分子只含有两种官能团 D.X分子可发生取代、消去、加成、氧化、缩聚反应 |
|
| 7. 选择题 | 详细信息 | ||||||||||||||||||
几种短周期元素的原子半径及主要化合价如下表所示:
|
|||||||||||||||||||
| 8. 选择题 | 详细信息 |
实验室利用CuCl2·2H2O热分解制备CuCl(在空气中易被氧化)并对分解产物的性质进行探究的装置(夹持仪器略)如图所示。下列有关叙述不正确的是( )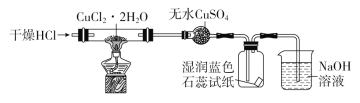 A.干燥的HCl的作用是防止生成的CuCl被氧化,可用干燥的N2代替 B.干燥管中无水CuSO4的作用是检验生成物水蒸气 C.湿润蓝色石蕊试纸先变红后褪色,可用品红溶液代替 D.NaOH溶液的作用是吸收尾气,但该装置容易导致倒吸 |
|
| 9. 选择题 | 详细信息 | |||||||||||||||
下列实验操作能达到实验目的的是( )
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
某学习小组在实验室中用废易拉罐(主要成分为 AI,含有少量的 Fe、Mg 杂质)制明矾[KAl(SO4)2·12H2O]的过秳如图所示。 下列说法正确的是 A.为尽量少引入杂质,试剂①应选用氨水 B.滤液 A 中加入 NH4HCO3 溶液产生 CO2 C.沉淀 B 的成分为 Al(OH)3 D.将溶液 C 蒸干得到纯净的明矾 |
|
| 11. 选择题 | 详细信息 |
COCl2 的分解反应为: COCl2(g)=Cl2(g)+CO(g) △H=+108 kJ•mol-1。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是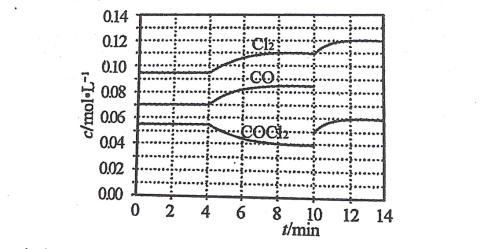 A.第 4min 时,改变的反应条件是升高温度 B.第 6min 时,V 正(COCl2)>V 逆(COCl2) C.第 8min 时的平衡常数 K=2.34 D.第 10min 到 14min 未标出 COCl2 的浓度变化曲线 |
|
| 12. 选择题 | 详细信息 |
下图是通过 Li-CO2 电化学技术实现储能系统和 CO2 固定策略的示意团。储能系统使用的电池组成为钌电极/CO2 饱和 LiClO4-(CH3)2SO(二甲基亚砜)电解液/锂片,下列说法不正确的是 A.Li-CO2 电池电解液为非水溶液 B.CO2 的固定中,转秱 4mole-生成 1mol 气体 C.钌电极上的电极反应式为 2Li2CO3+C - 4e-=4Li++3CO2↑ D.通过储能系统和 CO2 固定策略可将 CO2 转化为固体产物 C |
|
| 13. 选择题 | 详细信息 |
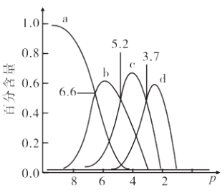 A.常温下,电离方程式: B.曲线c表示 C. D.常温下,向  变小 变小 |
|
| 14. | 详细信息 |
|
X、Y、Z、W是原子序数依次增大的短周期主族元素。通常状况下,X与W元素均能形成-1价的气态氢化物,Y为同周期主族元素中原子半径最大的元素,X、Z和W的原子最外层电子数之和为20。回答下列问题: (1)W在元素周期表中的位置是___。 (2)X和Y元素简单离子的半径较大的是___ (填离子符号);Z和W元素气态氢化物的稳定性较弱的是___(填化学式)。 (3)Y的氧化物中既含离子键又含共价键的是___(用电子式表示)。 (4)Z的最高价氧化物对应水化物的浓溶液(过量)和氧化亚铜共热,反应的化学方程式为___。 (5)Y2Z的溶液呈碱性的原因___(用离子方程式来表达)。 |
|
| 15. 实验题 | 详细信息 |
高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解,实验室以MnO2为原料制备MnCO3。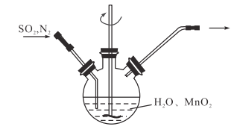 (1)制备MnSO4溶液: ①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是___(填标号)。 A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例 ②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择如图所示部分装置与图装置相连制备MnSO4溶液,应选择的装置有___(填标号)。 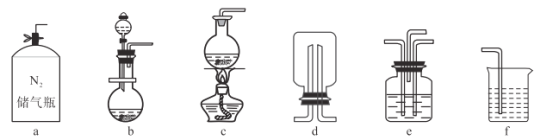 ③若用空气代替N2进行实验,缺点是___。(酸性环境下Mn2+不易被氧化) (2)制备MnCO3固体: 实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;②……;③在70~80℃下烘干得到纯净干燥的MnCO3固体。 步骤①中生成沉淀的离子方程式为:___。为得到纯净干燥的步骤MnCO3固体,②需要用到的试剂有___。 (3)问题讨论: 已知Mn(OH)2开始沉淀时pH=7.7,若选用饱和Na2CO3溶液(pH约为12)和MnSO4溶液作为反应原料制备MnCO3沉淀,最合理的加料方式的是___。 (4)实验设计 ①利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3)___(已知NiCO3为难溶于水的浅绿色固体)。 ②证明H2SO4的第二步电离不完全___。 |
|
| 16. | 详细信息 |
某厂用闪锌矿制备锌及颜料A(红棕色固体)的工艺流程如图所示。(闪锌矿的主要成分为ZnS,同时含有10%的FeS及少量CuS)。 已知:①闪锌矿在焙烧时会生成副产物ZnFeO4,ZnFeO4不溶于水及硫酸。Fe(HSO3)2难溶于水。 ②Ksp[Fe(OH)3]=1×10-39。 完成下列问题 (1)闪锌矿粉碎的目的是___,写出闪锌矿焙烧时发生的主要的化学方程式____。 (2)“滤液1”中选用足量的H2O2,理由是___。常温下,假设“②调节pH"前,滤液1中c(Fe3+)=1mol・L-1,则Fe3+完全沉淀时的pH至少为____。(离子浓度≤10-6mol·L-1规为完全除去)。 (3)“滤渣3”的成分为___(写化学式)。 (4)设计一种检验“颜料A”中是否含有Fe2+的实验方案___。 (5)“气体A”与“浸渣1”反应的化学方程式为___。 |
|
| 17. | 详细信息 |
|
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”。一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应: ①CO(g)+2H2(g) ②2CH3OH(g) ③CO(g)+H2O(g) (1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g) 判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为达到化学平衡状态的依据是___。 A.平均摩尔质量保持不变 B.容器的密度不变 C.容器内压强保持不变 D.单位时间内消耗2molCO2,同时消耗1mol二甲醚 (2)可采用CO和二甲醚催化合成乙醇。 反应①:CH3OCH3(g)+CO(g) 反应②:CH3COOCH3(g)+2H2(g) a.压强为pKpa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则△H1____(填“>”或“<”)0。 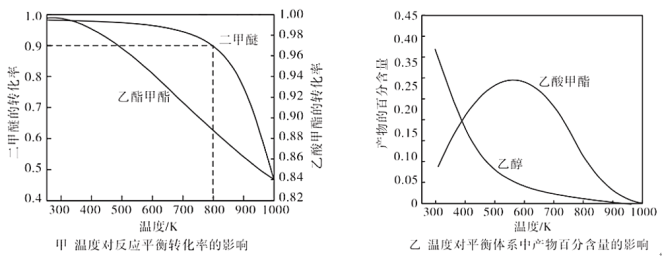 b.温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在300~600K范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:___。 c.若压强为pKpa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为___,该条件下反应①的平衡常数K=___。 (3)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是___极,电解时阳极的电极反应式为___。 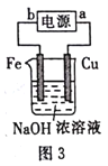 |
|
最近更新



