2019届高三第二学期等级考试质量监控化学试卷完整版(上海市松江区)
| 1. | 详细信息 |
|
《天工开物》中“凡石灰(CaCO3),经火焚炼为用”,该反应类型为 A. 化合反应 B. 复分解反应 C. 置换反应 D. 分解反应 |
|
| 2. | 详细信息 |
|
丙烷和丁烷是液化石油气的主要成分,它们互为 A. 同位素 B. 同素异形体 C. 同系物 D. 同分异构体 |
|
| 3. | 详细信息 |
|
以下过程与化学键断裂无关的是 A. 氯化钠熔化 B. 干冰升华 C. 金刚石熔化 D. 金属汞汽化 |
|
| 4. | 详细信息 |
|
下列电子式中错误的是 A. Na+ B. |
|
| 5. | 详细信息 |
|
漂粉精的有效成分是 A. Ca (ClO) 2 B. CaCl2 C. CaCO3 D. Ca(OH)2 |
|
| 6. | 详细信息 |
|
下列烷烃命名错误的是 A. 2-甲基丁烷 B. 3-甲基庚烷 C. 3,4-二甲基戊烷 D. 3-乙基戊烷 |
|
| 7. | 详细信息 |
|
25℃时,下列不能说明醋酸是弱酸的是 A. 0.1mol/L的醋酸溶液pH>1 B. 醋酸钠溶液pH>7 C. 稀醋酸溶液导电能力弱 D. 醋酸溶液中含有CH3COOH分子 |
|
| 8. | 详细信息 |
|
下列化学用语书写错误的是 A. 2Al+6H+→2Al3++3H2↑ B. HCO3- +OH-→CO32- +H2O C. 2Fe2++Cl2→2Fe3++2Cl- D. CO32-+2H2O |
|
| 9. | 详细信息 |
|
1mol氢气在氧气中完全燃烧生成水蒸气放出241.8千焦热量,下列热化学方程式正确的是 A. 2H2(g)+O2(g)→2H2O(g)+241.8kJ B. H2(g)+1/2O2(g)→H2O(g)+ 241.8 kJ C. H2(g)+1/2O2(g)→H2O(g)-241.8 kJ D. H2(g)+1/2O2(g)→H2O(l)+241.8 kJ |
|
| 10. | 详细信息 |
|
工业上合成氨的反应如下:N2(g) + 3H2(g) A. 升高温度 B. 增大容器体积 C. 移走氨气 D. 增加氮气 |
|
| 11. | 详细信息 |
|
下列物质溶于水时会破坏水的电离平衡,且属于强电解质的是 A. 硫酸钠 B. 氯化铝 C. 酒精 D. 一水合氨 |
|
| 12. | 详细信息 |
|
铝、铁两种金属粉末混合物,加入过量的盐酸溶液,过滤后向滤液中加入过量的烧碱溶液,再过滤,滤液中大量存在的离子有 A. Fe3+ B. AlO2- C. Al3+ D. Fe2+ |
|
| 13. | 详细信息 |
|
实验室制氨气的试剂及装置正确的是 A.  B. B.  C.  D. D.  |
|
| 14. | 详细信息 |
钢铁在海水中的锈蚀过程示意见右图,有关说法正确的是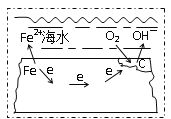 A. 电子从碳转移给铁 B. 在钢铁上连接铅块,可起到防护作用 C. 正极反应为:O2 + 2H2O + 4e →4OH- D. 该金属腐蚀过程为析氢腐蚀 |
|
| 15. | 详细信息 |
实验室制备乙酸丁酯的装置如图所示,下列分析错误的是 A. 加入过量乙酸可以提高丁醇的转化率 B. 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 C. 导气管a起到冷凝回流的作用 D. 制乙酸丁酯的反应温度超过100℃不能用水浴加热 |
|
| 16. | 详细信息 |
|
下列关于侯德榜制碱法的说法正确的是 A. 该法将合成氨法与氨碱法工艺联合,同时生产纯碱和氯化铵 B. 饱和食盐水中先通入CO2后通入NH3气体 C. 在析出NaHCO3的母液中加入消石灰以循环利用NH3 D. 析出的NH4Cl后的滤液中主要含有Na+、NH4+、HCO3-、Cl- |
|
| 17. | 详细信息 |
|
下列反应中,反应物的用量或浓度改变时,不会改变生成物的是 A. 铜与硝酸反应 B. 明矾溶液与烧碱溶液反应 C. 碳酸钠溶液和盐酸反应 D. 硫在氧气中燃烧 |
|
| 18. | 详细信息 |
|
过氧化钠是一种制氧剂,它和二氧化碳反应方程式为:2Na2O2+2CO2→2Na2CO3+O2下列说法正确的是 A. Na2O2是氧化剂,CO2是还原剂 B. Na2CO3是还原产物,O2是氧化产物 C. 每转移4摩尔电子,有1摩尔氧气生成, D. 1摩尔CO2参加反应就会产生11.2LO2 |
|
| 19. | 详细信息 |
|
实验室欲配制一种仅含4种离子(不考虑水电离出的离子)的溶液,且溶液中4种离子的浓度均为1mol / L,能达到此目的的是 A. Na+、Mg2+、SO42-、Cl- B. Al3+、K+、SO42-、NO3- C. CH3COO-、I-、K+、H+ D. Ba2+、OH-、CO32-、K+ |
|
| 20. | 详细信息 |
|
氮化硅(Si3N4)耐高温、硬度大,可用石英与焦炭在1400~1450℃的氮气中合成:3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)-Q(Q>0),在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列问题: (1)上述反应所涉及的属于第三周期的元素,其原子的最外层电子轨道表示式为______。其中一种元素的原子核外s电子数与p电子数相等,其原子的核外电子能量不同的有_____种。 (2)上述反应混合物中的极性分子是______,写出非极性分子的电子式________。分析用氮化硅制造轴承和发动机中耐热部件的原因是___________。 (3)该反应的平衡常数表达式为__________。可以提高二氧化硅转化率的措施是________(任写一条),该措施对平衡常数的影响为__________(填“增大”、“减小”或“保持不变”)。 (4)测得平衡时固体质量减少了5.6g,则用氮气表示的平均反应速率为__________。 |
|
| 21. | 详细信息 |
|
活性炭吸附法是工业提碘的主要方法之一。其流程如下: 完成下列问题: (1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向______________。 (2)流程中I2碘经过吸附,转化为I-、IO3-再转化为I2的过程,这样做的目的是_______。 (3)反应②发生时,由于碘在水中溶解度不大,溶液底部有固体生成;由于反应放热,有时溶液上方产生_____(填颜色)的气体。因此,反应②需要在______条件下进行。 (4)实验室从反应②所得溶液提取碘,可加入CCl4_______(填操作名称)碘,即把碘从水溶液中提取出来,并用________(填仪器名称)分离两种溶液。 (5)活性炭所吸附的I2也可以用NaHSO3将其转变为I-,该反应的氧化产物为_______(填微粒符号)。 已知NaHSO3溶液显弱酸性,试从平衡的角度解释原因____________。 向0.1mol/L的NaHSO3溶液中加入氨水至中性,请判断:c(Na+)____c(SO32–)+ c(HSO3–)+ c(H2SO3)(填“>”、“<”或“=”)。 |
|
| 22. | 详细信息 |
乙炔可以二聚也可以三聚。以乙炔为原料在不同的反应条件下转化,可以合成氯丁橡胶和对羟基苯甲酸。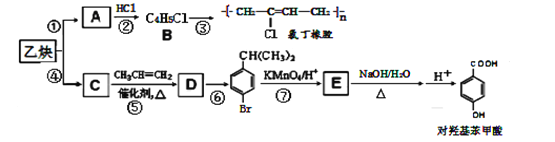 完成下列问题: (1)写出A的分子式____,E中官能团名称___、___(苯环除外),D的结构简式____。 (2)上述反应中,指出②的反应类型____;反应⑥所需的反应试剂及反应条件_____。 (3)E的同分异构体,满足苯环上有两个取代基,有____种。 (4)写出反应③的化学方程式_________。 (5)设计一条由(CH3)2C=CH2合成 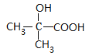 的路线。_______ 的路线。_______(合成路线常用的表示方式为: |
|
| 23. | 详细信息 |
|
为研究乙醇结构及其部分的化学性质,进行下列实验。完成下列问题: Ⅰ.用如图装置来推测乙醇的结构式。 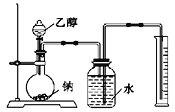 (1)实验中钠需要粉碎成很小的颗粒,其原因是__________。 (2)两次实验平均用乙醇1.15克,收集到气体体积平均为0.28升(换算成标准状态)。由实验数据可以推测乙醇分子的结构,依据是________。 (3)若使用的乙醇中含有少量的水,则收集到氢气的体积________。(偏大、偏小、无影响) Ⅱ.利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(固定和夹持装置已略去) 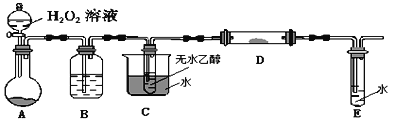 (4)装置A圆底烧瓶内的固体物质是________,C中热水的作用是__________。 (5)实验过程中D装置可以观察到的实验现象为_______。写出D处发生反应的化学方程式__________。实验进行一段时间后,如果撤去D处酒精灯,反应能否继续进行?_____。原因是_______。 (6)检验E中的生成物__________。 |
|
最近更新



