2017-2018年高二前半期期末考试化学考试(黑龙江省大庆实验中学)
| 1. 选择题 | 详细信息 |
|
下列有关氟氯烃的说法中,不正确的是( ) A. 氟氯烃是一种含氟和氯的卤代烃 B. 氟氯烃的化学性质稳定,有毒 C. 氟氯烃大多无色、无臭、无毒 D. 在平流层中,氟氯烃在紫外线照射下,分解产生的氯原子可引发损耗臭氧层的循环反应 |
|
| 2. 选择题 | 详细信息 |
|
将某有机物完全燃烧,生成CO2和H2O。将12 g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,又增重26.4g。该有机物的分子式为 A. C4H10 B. C2H6O C. C3H8O D. C2H4O2 |
|
| 3. 选择题 | 详细信息 |
|
下列有关实验的说法错误的是( ) A. 在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点 B. 用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和硝基苯的混合物 C. 在重结晶的实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失 D. 作为重结晶实验的溶剂,杂质在此溶液中的溶解度受温度影响应该很大 |
|
| 4. 选择题 | 详细信息 |
某小组为研究原电池原理,设计如图装置,下列叙述正确的是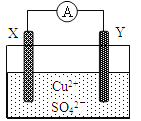 A. 若X为Fe,Y为Cu,铁为正极 B. 若X为Fe,Y为Cu,电子由铜片流向铁片 C. 若X为Fe,Y为C,碳棒上有红色固体析出 D. 若X为Cu,Y为Zn,锌片发生还原反应 |
|
| 5. 选择题 | 详细信息 |
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( ) A. O2在电极b上发生还原反应 B. 溶液中OH-向电极a移动 C. 反应消耗的NH3与O2的物质的量之比为4∶5 D. 负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O |
|
| 6. 选择题 | 详细信息 |
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )  A. X极是电源负极,Y极是电源正极 B. a极的电极反应是2Cl--2e-=Cl2↑ C. 电解过程中CuSO4溶液的pH逐渐增大 D. Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体 |
|
| 7. 选择题 | 详细信息 |
|
25℃时,水的电离达到平衡:H2O A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大 D.将水加热,Kw增大,pH不变,呈中性 |
|
| 8. 选择题 | 详细信息 |
|
下列叙述正确的是 A. 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 B. 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 C. 25℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 D. 0.1 mol AgCl和0.1 mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
|
| 9. 选择题 | 详细信息 | ||||||||
25 ℃时,有下列四种溶液:
|
|||||||||
| 10. 选择题 | 详细信息 |
|
常温下,向10mlbmol·L-1的CH3COOH溶液中滴加等体积的0.01mol·L-1的NaOH溶液,充分反应后溶液中c(CH3COO-)=c(Na+),下列说法不正确的是 A. b>0.01 B. 混合后溶液呈中性 C. CH3COOH的电离常数Ka= D. 向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小 |
|
| 11. 选择题 | 详细信息 |
|
有关溴乙烷的下列叙述中,正确的是 A. 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 B. 溴乙烷不溶于水,能溶于大多数有机溶剂 C. 溴乙烷与NaOH的醇溶液反应,可生成乙醇 D. 溴乙烷通常用溴与乙烷直接反应来制取 |
|
| 12. 选择题 | 详细信息 |
|
下列有关同分异构体数目的叙述不正确的是 A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 B. 与 C. 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种 D. 菲的结构简式为  ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
|
| 13. 选择题 | 详细信息 |
|
下列现象中,不是因为发生化学反应而产生的是( ) A.乙烯使酸性KMnO4溶液褪色 B.将苯滴入溴水中,振荡后水层接近无色 C.乙烯使溴的四氯化碳溶液褪色 D.甲烷与氯气混合,光照一段时间后黄绿色消失 |
|
| 14. 选择题 | 详细信息 |
某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当K闭合时,Y极上产生黄绿色气体。下列分析正确的是( ) A. 溶液中c(A2+)增大 B. B极的电极反应:B-2e-=B2+ C. Y电极上有Cl2产生,发生还原反应 D. 反应初期,X电极周围出现白色胶状沉淀 |
|
| 15. 选择题 | 详细信息 |
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和K2SO4溶液。下列说法正确的是( ) A. b电极上发生还原反应 B. 外电路电流方向是从a到b C. 电池工作时,盐桥中的SO42-移向甲烧杯 D. a电极上发生的反应为MnO4-+8H++5e-=Mn2++4H2O |
|
| 16. 选择题 | 详细信息 |
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( ) A. d为石墨,铁片腐蚀加快 B. d为石墨,石墨上电极反应为2H++2e-=H2↑ C. d为锌块,铁片不易被腐蚀 D. d为锌块,铁片上电极反应为2Cl--2e-=Cl2↑ |
|
| 17. 选择题 | 详细信息 |
|
下列事实: ①NaHSO4溶液呈酸性; ②长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结; ③加热能增加纯碱的去污能力; ④配制 CuCl2 溶液,用稀盐酸溶解CuCl2固体; ⑤NaHS溶液中c(H2S)>c(S2-); ⑥氯化铵溶液可作焊药去除金属制品表面的锈斑; ⑦加热FeCl3·6H2O晶体,往往得不到FeCl3固体。 其中与盐类的水解有关的叙述有( ) A. 7项 B. 6项 C. 5项 D. 4项 |
|
| 18. 选择题 | 详细信息 |
|
下列溶液中各微粒的浓度关系正确的是( ) A. 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)>c(Ba2+) B. 将10 mL 0.1 mol·L-1Na2CO3溶液逐滴滴加到10 mL 0.1 mol·L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) C. 向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)=c(HCO3-)+c(CO32-) D. 0.2 mol·L-1的某一元弱酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
|
| 19. 选择题 | 详细信息 | ||||||||
一定温度下,难溶电解质的饱和溶液中存在着沉淀溶解平衡,已知:
|
|||||||||
| 20. 选择题 | 详细信息 |
|
已知25 ℃时,Ka(HF)=6.0×10-4,Ksp(MgF2)=5.0×10-11。现向1 L 0.2 mol·L-1 HF溶液中加入 1 L 0.2 mol·L-1 MgCl2溶液。下列说法中正确的是( ) A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1 B. 0.2 mol·L-1 MgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-) C. 2HF(aq)+Mg2+(aq) D. 该反应体系中有MgF2沉淀生成 |
|
| 21. 填空题 | 详细信息 |
|
根据题目要求,用化学语言回答问题。 (I)除去下列括号内的杂质通常采用的实验方法是什么?将答案填在横线上。 (1)CH3CH2OH(H2O)_____________________________________________________; (2) (3) (II)某有机物的实验式为C2H6O,用质谱仪测定其相对分子质量,经测定得到如图1所示的质谱图;最后用核磁共振仪处理该有机物,得到如图2所示的核磁共振氢谱图。  试回答下列问题: (1)该有机化合物的相对分子质量为________。 (2)请写出该有机化合物的结构简式________。 (III)有机物E(C3H3Cl3)是一种播前除草剂的前体,其合成路线如下。  已知D在反应⑤中所生成的E,其结构只有一种可能,E分子中有3种不同类型的氯(不考虑空间异构)。试回答下列问题: (1)利用题干中的信息推测烃A的结构简式为______________。烃A的同系物中,相对分子质量最小的烃发生加聚反应的化学方程式为____________________________。 (2)写出下列反应的类型:反应①是____________,反应③是________。 (3)利用题干中的信息推测有机物D的名称是______________。 (4)试写出反应③的化学方程式:____________________________________。 |
|
| 22. 填空题 | 详细信息 |
|
某实验小组同学对电化学原理进行了一系列探究活动。 (1)如图为某实验小组依据氧化还原反应设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过________mol电子。  (2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极会产生气泡,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因________________________________________________________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO (3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝电极反应为___________;乙装置中石墨(1)电极现象为__________。  |
|
| 23. 填空题 | 详细信息 |
|
滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。 (I)中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。  (1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。 (2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。 (3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。 (4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。 (II)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO)。饮用水中的ClO2、ClO含量可用连续碘量法进行测定。ClO2被I-还原为ClO、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO也能被I-完全还原为Cl-。反应生成的I-用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI。  (1)请写出pH≤2.0时ClO与I-反应的离子方程式:_________________________。 (2)请完成相应的实验步骤: 步骤1:准确量取V mL水样加入到锥形瓶中; 步骤2:调节水样的pH为7.0~8.0; 步骤3:加入足量的KI晶体; 步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL; 步骤5:______________; 步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,又消耗Na2S2O3溶液V2 mL。 (3)根据上述分析数据,测得该饮用水中ClO的浓度为________ mol·L-1(用含字母的代数式表示)。 |
|
最近更新



