四川省成都市第七中学2020届高三上期期中考试理综化学题带答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生活、技术密不可分,下列有关说法错误的是 A. 天然气是高效清洁的化石燃料 B. 可利用离子反应处理水中的微量重金属元素 C. 油脂可以制取肥皂 D. 我国使用最早的合金是生铁 |
|
| 2. 选择题 | 详细信息 |
|
下列关于有机物的说法正确的是 A.分子式为C4H8O2的酯类物质共有4种异构体 B.甲基环已烷的一氯代物有4种(不考虑立体异构) C.乙烯能使溴水褪色、乙醇能使酸性KMnO4溶液褪色,它们发生反应的类型相同 D.乙酸、乙醇均能与金属钠反应,反映了它们含有相同的官能团 |
|
| 3. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A.在标准状况下,11.2 LNO 与11.2 L O2混合后所含原子数为NA B.110 g Na2S2中含有的离子数为3NA C.0.1 mol/LNa2CO3溶液中所含碳酸根数目小于0.1NA D.1 molCl2溶于足量水时,生成的H+数目为2NA个 |
|
| 4. 选择题 | 详细信息 |
新型电池的开发与使用在现代社会中已很普遍,一种水煤气燃料电池的能量转化率可达90%以上。下列说法不正确的是 A.总反应中包含有2CO+O2=2CO2 B.负极反应为H2-2e-=2H+、CO-2e-+H2O=CO2+2H+ C.电路中通过0.4 mol电子,电极消耗约4.48 L(标准状况)水煤气(CO:H2=1:1) D.有机固体中的H+在放电时向正极移动,造成正极pH不断减小 |
|
| 5. 选择题 | 详细信息 | ||||||||||||||||||||
下列有关实验现象和解释或结论都一定正确的是( )
|
|||||||||||||||||||||
| 6. 选择题 | 详细信息 |
|
A.纯净的E元素的最高价氧化物可用于制造光导纤维 B. C.由元素 D.元素A与 |
|
| 7. 选择题 | 详细信息 |
海水中含有80多种元素,是重要的资源宝库。已知不同pH条件下,海水中碳元素的存在形态如下图所示。下列说法不正确的是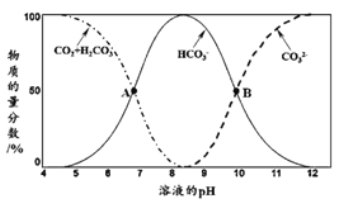 A.已知当前浅海pH=8.14,此中主要碳源为HCO B.A点,溶液中H2CO3和HCO C.当c(HCO D.Ka1与Ka2相差103倍左右 |
|
| 8. 实验题 | 详细信息 |
|
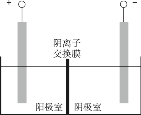
已知碘在酸性条件下被氯酸钾氧化成碘酸钾(KIO3),后与氯化钙反应生成碘酸钙。 I.制备碘酸钙 回答下列问题: (1)已知氧化性:ClO (2)制备装置(如图)中需用______(填“直形”或“球形”)冷凝管,反应产生的气体可用_____溶液尾气处理。 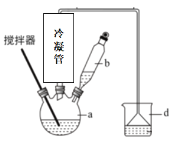 (3)水浴时,在烧瓶瓶颈处逐渐析出了一些紫红色固体,请解释此现象____。 (4)白色沉淀经过滤后,又依次用冰水、无水乙醇洗涤,使用乙醇洗涤的作用是____。 II.产品纯度测定 ①准确称取产品(不含结晶水)1.300 g,置于烧杯中,加入10 mL 1:1高氯酸,微热溶解试样,冷却后移入250 mL容量瓶中,用水稀释至刻度,摇匀。 ②移取试液25.00 mL,加入1:1高氯酸1 mL、碘化钾1.5 g; ③加入0.5%淀粉溶液2 mL,用浓度为c mol/L的Na2S2O3标准溶液滴定至终点。再平行测定两次。 回答下列问题: (5)写出②中反应的氧化产物与还原产物的物质的量之比是____;③中滴定终点的判断现象是_____________。 (6)已知测定时发生反应I2+2S2O |
|
| 9. | 详细信息 | |||||||||||||||||||||
|
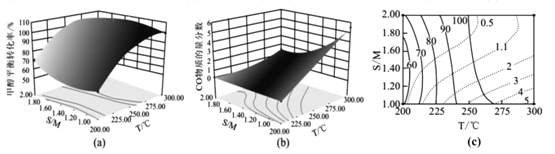
甲醇水燕气催化重整反应是生产氢能的有效方法之一:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)。 (1)利用双催化剂Cu/Cu2O对甲醇水蒸气重整反应催化的可能机理如下图,脱氢反应发生在Cu上,Cu2O 吸附含C微粒,中间产物M为_____(化学式)。 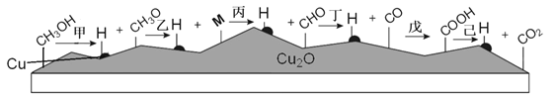 (2)上述机理可以整合为以下途径: 甲醇分解(I):CH3OH(g)=CO(g)+2H2(g) △H1(kJ/mol) 水煤气变换(II):CO(g)+H2O(g)=CO2(g)+H2(g) △H2(kJ/mol) 则催化重整反应的△H =_____kJ/mol (用含△H1、△H2的代数式表示)。 (3)甲醇分解(Ⅰ)、水煤气变换(II)的反应平衡常数Kp与温度关系见下表:
|
||||||||||||||||||||||
| 10. | 详细信息 | ||||||||||||
|
铅精矿可用于冶炼金属铅,其主要成分为PbS。 I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。 (1)用铅精矿火法炼铅的反应的化学方程式为_________。 (2)火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为:____。 II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下: 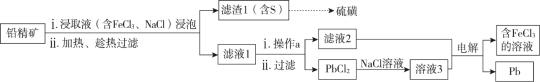 已知:① 不同温度下PbCl2的溶解度如下表所示。
|
|||||||||||||
| 11. 综合题 | 详细信息 |
|
三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种翠绿色晶体,在日光下照射,会因感光而部分变深蓝色,故常用于工程制图,即“蓝图”。K3[Fe(C2O4)3]·3H2O的制备反应为:2FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 = 2K3[Fe(C2O4)3]·3H2O。 回答下列问题: (1)上述氧化过程中,Fe(II)_____(答简化电子排布式)变为Fe(III)______(答外围电子排布图),基态Fe(III)电子占据______个不同轨道。 (2)对上述反应式中的短周期元素按照电负性由小到大排序为______。 (3)配合物K3[Fe(C2O4)3]的配位数为6,其配体C2O42—中的C的杂化方式为____杂化。 (4) H2O2属于______(填“极性”或“非极性”)分子。H2O2为二元弱酸,一级电离产物HO2—的立体构型是__________。H2O2沸点(150.2 ℃)比H2S沸点(-60.4 ℃)高,简要解释主要原因___________。 (5)将下列晶体的微粒配位数由大到小排序为________(填写代号) ① 金刚石;② 金属钾;③ 干冰 (6)FeO的晶胞结构为NaCl型,测知FeO晶胞边长为428pm,则此晶体中最近的Fe2+与Fe2+的距离为_________pm。(保留三位有效数字) |
|
| 12. | 详细信息 |
F是一种常见的α-氨基酸,可通过下列路线人工合成: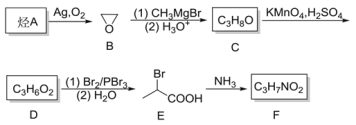 回答下列问题: (1)化合物E中的官能团名称是___________,烃A的结构简式是____________。 (2)由化合物D生成E、醇C生成D的反应类型分别是___________、___________。 (3)化合物F的系统命名为____________,F相互形成的环状二肽的结构简式为___________。 (4)化合物C可在灼热CuO催化下与O2发生反应,得到一种具有刺激性气味的液体,写出相关的化学方程式____________。 (5)0.05 mol化合物E与足量NaOH醇溶液加热反应,最多消耗NaOH的物质的量为_____。 (6)烃A可与苯酚在酸性条件下产生苯酚对位取代衍生物G(C8H10O),其满足如下条件的G的同分异构体有_______种。 ①遇FeCl3溶液不显紫色;②苯环上至多有两个取代基;③有醚键。 |
|