2018-2019高二上册期中模考化学(湖北省黄冈市黄冈中学)
| 1. 选择题 | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是 A. 新制的氯水在光照条件下颜色变浅 B. 合成氨工业中使用铁触媒作催化剂 C. 红棕色的NO2气体,加压后颜色先变深后变浅 D. 工业生产硫酸的过程中,通入过量的空气以提高二氧化硫的转化率 |
|
| 2. 选择题 | 详细信息 |
|
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( ) A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) B. c(H+)+c(NH4+)>c(OH-)+c(HCO3-)+2c(CO32-) C. c(Cl-)>c(HCO3-)>c(NH4+)>c(CO32-) D. |
|
| 3. 选择题 | 详细信息 |
|
下列对化学平衡移动的分析中,不正确的是( ) ①已达平衡的反应C(s)+H2O(g) ⇌CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g) ⇌2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应平衡时,若减小反应器容积时,平衡一定移动 ④有气体参加的反应平衡时,在恒压反应器中充入稀有气体,平衡一定不移动 A. ①④ B. ①②③ C. ②③④ D. ①②③④ |
|
| 4. 选择题 | 详细信息 |
|
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) A. v(NH3)=2v(CO2) B. 密闭容器中NH3体积分数不变 C. 反应吸收a kJ热量 D. 密闭容器中混合气体的密度不变 |
|
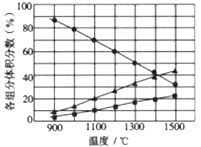
| 5. 选择题 | 详细信息 | ||||||||||||
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+ H2O(g)
|
|||||||||||||
| 6. 选择题 | 详细信息 |
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1.56×10-10。如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]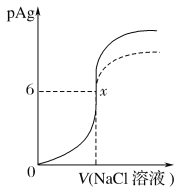 A. 原AgNO3溶液的物质的量浓度为0.1 mol·L-1 B. 图中x点的坐标为(100,6) C. 图中x点表示溶液中Ag+恰好完全沉淀 D. 把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图像在终点后变为虚线部分 |
|
| 7. 选择题 | 详细信息 |
|
在 25 ℃、101 kPa 时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1,Cl2(g)+H2(g)===2HCl(g) ΔH2 2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3.则ΔH3 与ΔH1 和ΔH2 间的关系正确的是 ( ) A. ΔH3=ΔH1+2ΔH2 B. ΔH3=ΔH1+ΔH2 C. ΔH3=ΔH1-2ΔH2 D. ΔH3=ΔH1-ΔH2 |
|
| 8. 选择题 | 详细信息 |
|
25 ℃时,将浓度为0.1 mol·L-1 的Na2S溶液加水不断稀释,下列各量始终减小的是 A. c(OH-) B. n(Na+) C. |
|
| 9. 选择题 | 详细信息 |
一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应: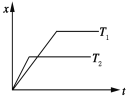 mA(s)+nB(g) A. 容积扩大到原来的两倍,平衡向逆反应方向移动 B. 化学方程式中n>p+q C. 达到平衡后,若升高温度,平衡向逆反应方向移动 D. 达到平衡后,增加A的量,有利于提高B的转化率 |
|
| 10. 选择题 | 详细信息 |
在体积为2L的恒容密闭容器中发生反应xA (g) +yB (g) 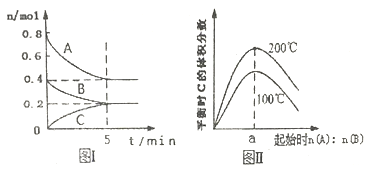 A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 B. 图Ⅱ所知反应xA(g)+yB(g) C. 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v正>v逆 D. 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50% |
|
| 11. 选择题 | 详细信息 |
|
化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为Cu2+(aq)+MnS(s) A. CuS的溶解度比MnS的溶解度小 B. 该反应达到平衡时:c(Cu2+)=c(Mn2+) C. 往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 D. 该反应平衡常数:K= |
|
| 12. 选择题 | 详细信息 |
|
常温下,下列有关叙述正确的是() A. 同浓度的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③ B. Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) C. 10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≥20mL D. 0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
|
| 13. 选择题 | 详细信息 |
|
一定条件下,容积固定的密闭容中对于可逆反应X(g)+3Y(g) A. c1∶c2=1∶3 B. 平衡时,Y和Z的生成速率之比为2∶3 C. 达到平衡时,容器内的压强不再变化 D. c1的取值范围为0 mol/L<c1<0.14 mol/L |
|
| 14. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||
温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)
|
|||||||||||||||||||||||||||||||||
| 15. 选择题 | 详细信息 |
已知298K时,某碱MOH的电离平衡常数Kb=1.0×10-5;电离度a=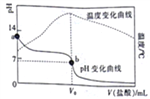 A. a点对应的溶液中:c(OH-)=(M+)+<(H+) B. b点对应的V。=20.00mL C. 298K时,0.1000mol/LMOH溶液中,MOH的电离度a=1% D. 298K时,将0.1molMOH和0.1moMCl溶于水配制成1L混合溶液,溶液的pH>9 |
|
| 16. 选择题 | 详细信息 |
近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的 CO、 NO2 等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气 体,反 应方程式为4CO(g)+2NO2(g)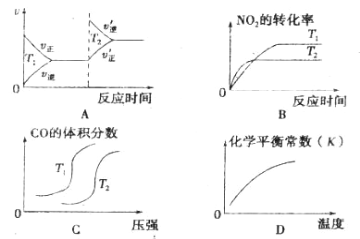 A. A B. B C. C D. D |
|
| 17. 选择题 | 详细信息 | ||||||||
T℃时,三种酸的电离平衡常数如下表,下列判断不正确的是
|
|||||||||
| 18. 选择题 | 详细信息 |
|
已知:25℃时 H2C2O4 的 pKa1=1.22,pKa2=4.19,CH3COOH 的 pK a=4.76,K 代表电离平衡常数,pK = -1gK。下列说法正确的是 A. 浓度均为 0.1mol·L-1NH4HC2O4 和 CH3COONH4 溶液中:c(NH4+)前者小于后者 B. 将 0.1mol·L-1 的 K2C2O4 溶液从 25℃升温至 35℃,c(K+)/c (C2O42-) 减小 C. 0.1 mol·L-1K2C2O4 溶液滴加盐酸至 pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-) D. 向 0.1 mol·L-1CH3COONa 溶液中滴加少量 0.1 mol·L-1H2C2O4 溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4 |
|
| 19. 综合题 | 详细信息 | ||||||||||
|
(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答: Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为 ⅰ.COS(g)+H2(g) ⅱ.CO(g)+H2O(g) 已知断裂1mol气态分子中的化学键所需能量如下表所示。
|
|||||||||||
| 20. 推断题 | 详细信息 | ||||||||||||
|
Ⅰ.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中, 采用废易拉罐(主要成分为 Al,含有少量的 Fe、Mg 杂质)制备明矾的过程如下图所示。 回答下列问题: (1)为尽量少引入杂质,试剂①应选用______________(填标号)。 a.HCl 溶液 b.H2SO4 溶液 c.氨水 d.NaOH 溶液 (2)易拉罐溶解过程中主要反应的化学方程式为_________________________。 (3)沉淀 B 的化学式为______________________ II.毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O 的流程如下: 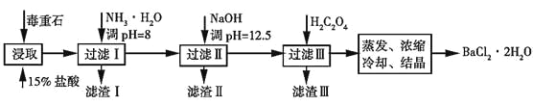 (4)毒重石用盐酸浸取前需充分研磨,目的是_________________________________。
|
|||||||||||||
| 21. 综合题 | 详细信息 |
|
(1)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。 ①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管 (2)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。 以下为废水中铬元素总浓度的测定方法:_______________________ 准确移取25.00 mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015 mol·L-1的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00 mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。已知测定过程中发生的反应如下: ①2Cr3++3S2O82-+7H2O===Cr2O72-+6SO42-+14H+ ②Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O ③I2+2S2O32-===2I-+S4O62- (3)Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。 测定产品(Na2S2O3·5H2O)纯度 准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为:2S2O32-+I2===S4O62-+2I- 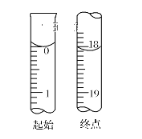 ①滴定至终点时,溶液颜色的变化:________。 ②滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。 |
|