江苏省徐州市2020-2021年九年级上半年12月月考联考化学在线考试题带答案和解析
| 1. 选择题 | 详细信息 |
|
下列反应中不属于置换反应的是 A.H2+CuO C.2Na+2H2O=2NaOH+H2↑ D.2Na2O2+2H2O=4NaOH+O2↑ |
|
| 2. 选择题 | 详细信息 |
|
下列说法中错误的是 A.真金不怕火炼是指金的熔点高 B.反应PbS+4H2O2=X+4H2O中X的化学式是PbSO4 C.存放易燃易爆物的仓库,严禁穿化纤衣服入内 D.用金属钨做灯丝主要是利用其熔点高 |
|
| 3. 选择题 | 详细信息 |
|
下列有关燃烧与灭火的说法正确的是 A.为防止森林大火蔓延可开挖隔离带,其目的是隔离可燃物 B.房屋失火,消防队员用水扑灭是因为降低了可燃物的着火点 C.石蜡、酒精等燃烧的生成物中有且只有水和二氧化碳生成 D.发现煤气泄露,立即打开抽油烟机或排气扇的开关,再关闭阀门 |
|
| 4. 选择题 | 详细信息 | |||||||||||||||
下图所示的四个实验中,得出的结论正确的是
|
||||||||||||||||
| 5. 选择题 | 详细信息 |
如图,向盛水的试管里加入少量的某固体,U型管内的液面发生的现象为A处升高,B处降低。下列说法正确的是 A.该物质溶于水吸热,可能是NaOH B.该物质溶于水吸热,可能是NH4NO3 C.该物质溶于水放热,可能是NaOH D.该物质溶于水放热,可能是NaCl |
|
| 6. 选择题 | 详细信息 |
|
过氧化钠(Na2O2)能与二氧化碳反应生成氧气,可作为呼吸面具中氧气的来源,有关反应为2Na2O2+2CO2=2Na2CO3+O2。从该反应获取的以下信息中,正确的是 ①过氧化钠属于氧化物 ②该反应前后分子个数发生改变,所以不遵循质量守恒定律 ③反应前后部分氧元素的化合价发生变化 ④实验室可利用这一原理制取纯净的氧气 A.①③ B.②④ C.②③④ D.①②③ |
|
| 7. 选择题 | 详细信息 |
|
向含有H2SO4和CuSO4的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中再滴加稀硫酸,有气体生成,则滤出的固体一定为 A.Cu B.Cu、Fe混合物 C.Fe D.Fe与CuSO4的混合物 |
|
| 8. 选择题 | 详细信息 | ||||||||
下表是某同学错题本中整理的部分内容,其中全部正确的是
|
|||||||||
| 9. 选择题 | 详细信息 |
|
下列说法或实验方案中正确的是 A.除去CO2气体中的少量CO,可以用点燃的方法来完成 B.甲醛分子(化学式为CH2O)由碳原子、氢气分子、氧原子构成 C.用黄铜片在铜片上刻划,铜片上有划痕,则黄铜的硬度比铜的大 D.“2gH2和20gO2充分反应后生成18gH2O”不符合质量守恒定律 |
|
| 10. 选择题 | 详细信息 | |||||||||||||||
在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是
|
||||||||||||||||
| 11. 填空题 | 详细信息 |
|
(1)用化学用语表示: ①稀硫酸能导电的原因是因为溶液中有自由移动的H+和_______。 ②2个氮气分子_______。 ③铝比铁活泼,但铝箔比铁钉耐腐蚀,是因为_______(用方程式表示)。 (2)选取相应物质填空: ①硬铝、不锈钢是常见的金属材料。它们属于_______(填“合金”或“纯金属”)。 ②高层建筑的避雷装置,这主要是利用了金属材料的_______(填序号)。 A 密度大 B 导电性 C 导热性 D 熔点高 ③下列常见物质与水混合,能形成溶液的是_______。 A 蔗糖 B 面粉 C 白酒 D 花生油 |
|
| 12. 流程题 | 详细信息 |
为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下: 请回答: (1)金属B是_____; (2)操作a的名称是_____。 (3)步骤②所涉及的化学反应方程式:_____ (4)实验室中要除去细碎铜屑中的少量细碎铁屑,某学生设计了两个方案: ① ② 两个方案比较,你认为较好的是___(填序号),理由是____,请思考写出更简便的方法:____。 |
|
| 13. 实验探究题 | 详细信息 | ||||||||
王宏同学组装了下图实验装置,验证一氧化碳的部分性质并验证产物。 (1)写出图中标号仪器的名称:①_______;②_______。 (2)实验中B装置硬质玻璃管中发生反应的化学方程式为:_______; (3)C装置实验过程中的现象是_______,其中反应的化学方程式为_______。 (4)该同学实验完成后,发现C装置中过量的澄清石灰水增重0.44g,则该同学通入装置的CO气体质量_____(填“>”、“<”或“=”)0.28g。 (5)下列对该实验的分析正确的是_______(选填编号)。 ①实验结束时应先熄灭D处酒精灯。 ②反应后得到的黑色粉末全部能被磁铁吸引,说明氧化铁已全部转化为铁。 ③实验结束待玻璃管内物质冷却至室温才停止通CO,可防止高温下铁被重新氧化。 ④反应结束时B装置硬质玻璃管中固体减少的质量为0.8g,则C中增加的质量为2.2g。 (6)①为研究实验产物的成分,王宏同学查阅了相关资料,得知 一氧化碳还原氧化铁是一个逐渐的过程: 首先是Fe2O3被还原为Fe3O4: 然后是Fe3O4被还原为FeO:______+______ 最后是FeO被还原为Fe:  又查知:FeO、Fe3O4均为黑色,且Fe3O4有磁性;FeO、Fe3O4都不与硫酸铜溶液反应。 ②结合上述资料,王宏同学对反应后黑色固体的成分进行了猜想: 猜想一:Fe与Fe3O4; 猜想二:Fe与FeO; 猜想三:Fe与Fe3O4和FeO。 ③为了对产物固体的成分进行更客观的分析,王宏同学将所做实验整理如下:
④实验反思:为了提高铁的产率,应适当_______(填“降低”或“提高”)反应温度。 |
|||||||||
| 14. 科学探究题 | 详细信息 |
|
某化学研究小组对蜡烛(主要由碳、氢元素组成)燃烧进行了如下探究。 (1)设计图 1 所示实验,锥形瓶中发生反应的化学方程式为_____。请推测靠近三通管_____(填“上口”或“下 口”)的火柴火焰熄灭,理由是_____。 (2)某同学用大烧杯将高低 2 支燃烧的蜡烛罩住,观察到高的蜡烛先熄灭,低的蜡烛后熄灭。 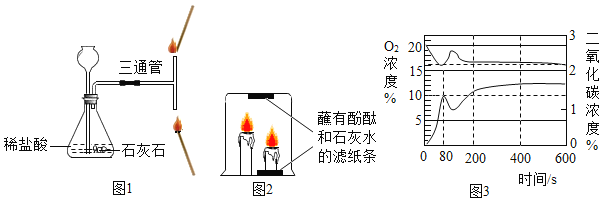 (提出问题)导致高的蜡烛先熄灭的原因是什么? (猜想与假设) 假设 1:可能是高蜡烛火焰附近的二氧化碳含量过大导致其先熄灭; 假设 2:可能是高蜡烛火焰附近的氧气浓度过低导致其先熄灭。 (设计实验) 甲同学按图 2 装置进行实验,点燃蜡烛,用大烧杯罩住。一段时间后,发现贴在烧杯内上部的滤纸条先褪色。说明此时高蜡烛附近的二氧化碳浓度比低蜡烛附近的浓度_____(填“高”或“低”)。 (3)为进一步验证假设 1,乙同学收集 1 瓶含 20%氧气和 80%二氧化碳的气体,将点燃的蜡烛慢慢伸入瓶中并密闭,蜡烛点燃一段时间后慢慢熄灭,根据实验现象可知:假设 1_____(填“合理”或“不合理”)。 (4)丙同学使用传感器测得密闭装置内蜡烛从燃烧到熄灭后的过程中(80 s 时蜡烛熄灭),装置内氧气和二氧化碳含量的变化曲线如图 3 。 则可得蜡烛燃烧的条件是_____。 (5)结合已有知识和上述实验分析,乙同学实验中,蜡烛完全熄灭后瓶内含有的气体有_____。 |
|
| 15. 计算题 | 详细信息 | ||||||||||||||||||
Cu与Zn的合金称为黄铜。某化学兴趣小组的同学为了测定某黄铜的组成,取20g该黄铜样品于烧杯中,向其中分5次加入相同的稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体的质量记录于下表:
试回答下列问题: |
|||||||||||||||||||