运城市高三化学高考模拟(2019年下学期)免费试卷完整版
| 1. | 详细信息 |
|
化学与生产、生活、材料等密切相关,下列叙述正确的是 A. 可用热的饱和碳酸钠溶液除去金属表面的矿物油 B. 明矾溶于水会形成胶体,因此可用于自来水的杀菌消毒 C. “地沟油”不能食用,但可以加工成肥皂或生物柴油 D. 聚乙烯、聚氯乙烯和碳纤维都是有机高分子材料 |
|
| 2. | 详细信息 |
|
下列关于有机化合物的说法正确的是 A. 煤中含有苯、甲苯和粗氨水,可通过干馏得到 B. C4H8Cl2的同分异构体有7种 C. 甲苯和乙苯分子内共平面的碳原子数最多均为7 D. 由乙醇和乙酸生成乙酸之酯属于取代反应 |
|
| 3. | 详细信息 |
|
下列所示物质的制备方法合理的是 A. 实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏 B. 金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭 C. 从卤水中(溶质主要是MgCl2)提取Mg 卤水 D. 由食盐制取漂粉精NaCl(ag) |
|
| 4. | 详细信息 |
下列实验内容(装置操作或现象)能达到相应实验目的的是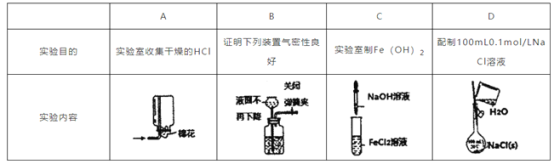 A. A B. B C. C D. D |
|
| 5. | 详细信息 |
|
X、Y、Z、W均为短周期主族元素且原子序数依次增大,Y原子最外层比Z原子最外层多1个电子实验室可用Z的单质与烧碱反应制备少量气体X2,W的单质可用于自来水消毒。下列说法正确的是 A. Z的氢氧化物与Y、W的最高价含氧酸均能反应 B. 简单离子半径:Z<W C. Z、W形成的化合物的水溶液呈碱性 D. 工业上常用X、W的单质在光照条件下制备XW |
|
| 6. | 详细信息 |
当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是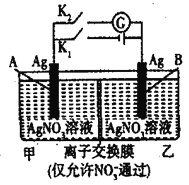 A. 当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加 B. 断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 C. 实验开始先断开K1,闭合K2,此时NO3-向B电极移动 D. 当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大 |
|
| 7. | 详细信息 |
25℃下部分弱酸的电离常数如表。下列有关说法不正确的是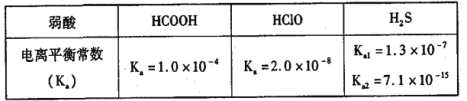 A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c( HCOOH)/c(HCOO-)=10 B. 相同pH的 HCOONa和NaClO溶液中离子总浓度前者大 C. 等浓度等体积的Na2S和 HCOOH混合后:c(Na+)=2c(HCOO-)+2c( HCOOH) D. 向NaClO溶液中通入H2S发生的反应为ClO-+H2S |
|
| 8. | 详细信息 |
|
某合作学习小组的同学验证文献上用乙烯气脱除氮氧化物。回答下列问题: (1)甲组同学设计实验制取纯净的乙烯气体和NO。 ①设计的制备C2H4装置如图所示: 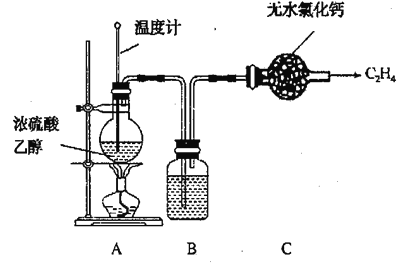 资料:C2H5OH C2H5OH+2H2SO4(浓) C+2H2SO4(浓) 写出乙烯的电子式___________ 装置B中盛放的试剂为___________(填小写字母)。 a KMnO4溶液 b Br2/CCl4溶液 c 浓NaOH溶液 d 浓硫酸 ②设计图装置制备NO气体 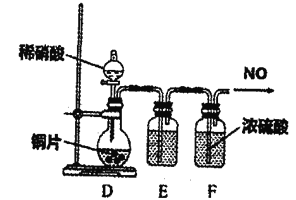 装置D烧瓶中的实验现象为:___________; 装置E盛放的试剂是___________。 (2)乙组利用甲组制得的C2H4和NO并选用下列装置进行催化反应,并检验乙烯的氧化物CO和CO2(部分装置可重复使用,已知C2H4可被热的CuO氧化为碳的氧化物,酸性高锰酸钾可氧化NO和C2H4,不氧化CO)。 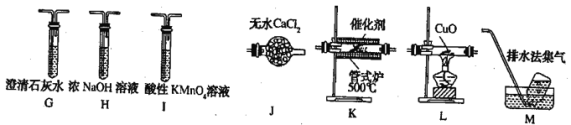 ①各装置的连接顺序为: ②K后接的G的作用是___________。 ③酸性高锰酸钾溶液的作用是___________。 ④证明乙烯的氧化产物中有CO的现象是___________; 若NO还原为N2,乙烯氧化为等物质的量的CO和CO2,则反应的化学方程式为___________。 |
|
| 9. | 详细信息 |
三盐基硫酸铅(3PbO·PbSO4·H2O,不溶于水)主要适用于不透明的聚氯乙烯硬质管、注射成型制品,也可用于人造革等软质制品。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。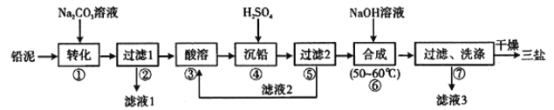 已知:Ksp(PbSO4)=1.82×10-8,Ksp (PbCO3)=1.46×10-13 请回答下列问题: (1)加入碳酸钠溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq),通过计算(保留2位有效数字)说明该反应程度很大的原因:___________。这一步骤中,也可以将碳酸钠溶液改为碳酸氢钠溶液,写出用碳酸氢钠溶液时的离子方程式:___________。 (2)根据图溶解度曲线(g/100g水),由滤液I得到Na2SO4固体的操作为将“滤液1”___________、___________、用乙醇洗涤后于燥。 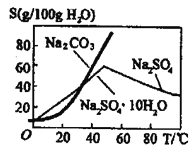 (3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是___________(任意写出一条),生成NO的离子方程式:___________。 (4)“滤液2”中可循环利用的溶质为___________(填化学式)。 步骤④“沉铅”时若将Pb(NO3)2溶液与0.02mol·L-1的H2SO4等体积混合生成PbSO4沉淀时,所需Pb(NO3)2溶液的最小物质的量浓度为___________mol·L-1。 |
|
| 10. | 详细信息 |
|
“低碳经济”备受关注,CO2的排集、利用与封存成为科学家研究的重要课题。 (1)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应 CO2(g)+CH4(g) ①已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1 CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1 CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1 则反应CO2(g)+CH4(g) (2)为了探究反应CO2(g)+CH4(g) ①平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图):v正(CO2)和v逆(CO),则与v正(CO2)相对应的是图中曲线___________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为___________(填“D”“E”或“F”),判断的理由______________________。 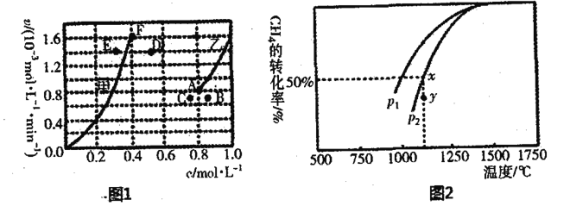 ②又测得CH4的平衡转化率与温度及压强的关系如图,当压强为P2时,在y点:v(正)___________v(逆)(选填“大于”、“小于”或“等于”);压强p1___________p2(选填“大于”、 “小于”或“等于”),原因是___________; 若p2=6MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。 |
|
| 11. | 详细信息 |
|
根据周期表中元素原子结构性质回答下列问题: (1)C原子价层电子的轨道表达式为___________,基态As原子中,核外电子占据的最高能级的电子云轮廓图为___________形。 (2)已知等电子体具有相似的结构和化学键特征,O22+与元素N的单质互为等电子体,则O22+的电子式为___________。 (3)NH3能与众多过渡元素离子形成配合物,向CuSO4溶液中加入过量氨水,得到深蓝色溶液,向其中加人乙醇析出深蓝色晶体,加入乙醇的作用___________,该晶体的化学式为___________。 (4)如图EMIM+离子中,碳原子的杂化轨道类型为___________。分子中的大π键可用符号πnm表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则EMM+离子中的大π键应表示为___________。  (5)NiO晶体结构与NaCl相似,晶胞中Ni2+位置在顶点和面心,则晶胞中O2-位置在___________,已知晶体密度为dg/cm3,N2+原子半径为xpm,O2-原子半径为ypm阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为___________(列出化简后的计算式)。 |
|
| 12. | 详细信息 |
2一氨-3—氯苯甲酸是白色晶体,其制备流程如下: 已知:  回答下列相关问题 (1) (2)反应①中R代表的是_____________,反应②的反应类型为_____________。 (3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。 (4)A的结构简式为_____________,⑥的反应条件为_____________。 (5)符合下列条件的同分异构体的结构简式为_____________。 a.式量比 b.与酸性KMnO4反应能生成二元羧酸 c.仅有3种等效氢 (6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。 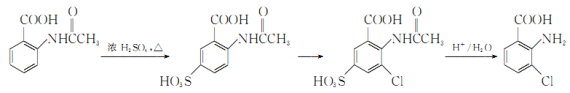 分析产率提高的原因是_____________。 |
|
最近更新



