泰安市高三化学期中考试(2018年上半期)带答案与解析
| 1. 选择题 | 详细信息 |
|
下列有关操作的说法不正确的是 A. 《本草经集注》记载了鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”,此处运用了物质升华的性质 B. 《本草纲目》记载了烧酒的制作工艺:“凡酸坏之酒,皆可蒸烧”,此处用到的操作是蒸馏 C. 《肘后备急方》一书中有“青蒿一握,以水二升渍,绞其汁”,此处用到的操作是溶解 D. 唐诗有“千淘万漉虽辛苦,吹尽黄沙始得金”的诗句,此处用到的操作是过滤 |
|
| 2. 选择题 | 详细信息 |
|
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是 A. 根据溶液导电能力强弱,将电解质分为强电解质和弱电解质 B. 根据分散系是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 C. 根据纯净物中的元素组成,将纯净物分为单质和化合物 D. 根据反应中的能量变化,将化学反应分为氧化还原反应和非氧化还原反应 |
|
| 3. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 二氧化氯是一种高效安全的消毒剂 B. 沙子、石英、水晶等都是天然存在的二氧化硅 C. SO2能漂白石蕊试液、高锰酸钾溶液 D. 还原铁粉可以用作食品袋内的抗氧化剂 |
|
| 4. 选择题 | 详细信息 |
|
下列化学用语正确的是 A. 硫原子结构示意图: B. 次氯酸分子的结构式:H—O—C1 C. H2O2的电子式: D. 碳酸氢钠的电离方程式:NaHCO3==Na++H++CO32- |
|
| 5. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的数值。下列叙述正确的是 A. 将NA个NH3分子溶于1L水中得到1mol·L-1的氨水 B. 15.6g由Na2O2和Na2S组成的混合物中含阴离子数为0.2NA C. 一定条件下,0.1mol N2与0.3 mol H2充分反应,生成NH3分子数为0.2NA D. 1mol Cl2参加反应,转移的电子数一定为2NA |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||
下图表示的一些物质或概念间的从属关系中正确的是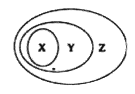
|
|||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
下列各组离子能大量共存的是 A. pH=2的溶液中:NH4+、Na+、Cu2+、Cl- B. “84”消毒液的水溶液中:Fe2+、Ca2+、H+、Cl- C. 加入KSCN显红色的溶液中:K+、NH4+、Cl-、S2- D. 白醋中:K+、Na+、CO32-、SO42- |
|
| 8. 选择题 | 详细信息 |
短周期主族元素W、X、Y、Z的原子序数之和为46,它们在周期表中的相对位置如图所示。下列说法正确的是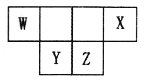 A. 原子半径大小顺序为:Y>Z>X B. X元素最高价氧化物的水化物酸性最强 C. Y元素的简单氢化物稳定性最强 D. Z单质难溶于化合物WZ2 |
|
| 9. 选择题 | 详细信息 |
|
三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是 ( ) A. 原子数目相等的三种气体,质量最大的是Z B. 相同条件下,同质量的三种气体,气体密度最小的是X C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol D. 同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2∶1 |
|
| 10. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列除杂方案错误的是
|
||||||||||||||||||||||||||
| 11. 选择题 | 详细信息 |
|
下列叙述正确的有 ①碱性氧化物:Na2O2、MgO、A12O3 ②常温下Cu、Fe、Al均不能和浓硫酸发生化学反应 ③Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得 ④分别以熔融的NaCl、MgCl2、Al2O3为原料通过电解法制取金属Na、Mg、Al ⑤碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的均一、透明的分散系分别为:溶液、胶体 A. ①④⑤ B. ③④⑤ C. ②③④ D. ②④⑤ |
|
| 12. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是 A. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2A13++3SO42-+3Ba2++6OH-=3BaSO4↓+2A1(OH)3↓ B. 将SO2气体通入NaC1O溶液中:SO2+2C1O-+H2O==SO42-+2HC1O C. 向FeBr2溶液中通入过量C12:2Fe2++4Br-+2C12==2Fe3++2Br2+4C1- D. VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O===Mn2++5VO2++2H+ |
|
| 13. 选择题 | 详细信息 |
下列有关实验装置或操作进行的相应实验,能达到实验目的的是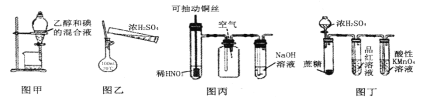 A. 用图甲所示装置分离乙醇和碘的混合液 B. 用图乙所示操作配制100mL 0.1mol·L-1硫酸溶液 C. 用图丙所示装置制备、收集纯净的一氧化氮 D. 用图丁所示装置检验浓硫酸与蔗糖反应产生的二氧化硫 |
|
| 14. 选择题 | 详细信息 |
海水综合利用的工艺流程如图所示(粗盐中的可溶性杂质有MgC12、CaC12、Na2SO4)。下列说法错误的是 A. 步骤①加入试剂的顺序:水→NaOH溶液→Na2CO3溶液→BaC12溶液→过滤后加盐酸 B. 步骤②的操作是在氯化氢气流中加热MgC12·6H2O C. 从步骤③到步骤⑤的目的是为了浓缩富集溴 D. 火力发电厂燃煤排放的含SO2的烟气经处理后可用在步骤④反应中 |
|
| 15. 选择题 | 详细信息 |
|
某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2===4LiCl+S+SO2。下列有关判断正确的是 A. 反应中被氧化的元素有Li和S B. SOCl2既是氧化剂又是还原剂 C. 还原产物包括LiCl和S D. 生成标况下1.12L SO2时,反应转移电子为0.2mol |
|
| 16. 选择题 | 详细信息 |
己知A、B、C、D之间的置换转化关系如图所示、且A、D为单质。下列说法正确的是 A. 若A为Fe,D为H2,则B一定为酸 B. 若A为非金属单质,则D 不一定为非金属单质 C. 若A为金属单质,D为非金属单质,则D一定是H2 D. 若A、D均为金属单质,则组成元素的金属性A必强于D |
|
| 17. 选择题 | 详细信息 |
“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存利用。利用NaOH溶液来“捕捉”CO2的过程如图所示(部分条件及物质未标出)。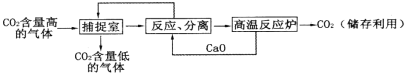 下列说法错误的是 A. 能耗大是该方法的一大缺点 B. 整个过程中,有2种物质可以循环利用 C. “反应、分离”环节中,有复分解反应发生 D. “反应、分离”环节中,分离的基本操作是蒸发、结晶 |
|
| 18. 选择题 | 详细信息 |
|
将32.5g Zn投入到V mL浓硫酸中共热,恰好完全反应,则可以确定的数据是 A. 所得溶液的浓度 B. 所得气体的质量 C. 所得气体在标准状况下的体积 D. 原硫酸的浓度 |
|
| 19. 推断题 | 详细信息 |
随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。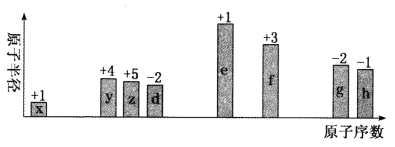 回答下列问题: (1)用于文物年代测定的元素,其核素符号为_________。元素z在周期表中的位置是____________。 (2)元素d、e、f、g原子的简单离子半径由大到小的顺序为_________(用离子符号表示)。 (3)元素f的单质与元素e的最高价氧化物对应的水化物反应的化学方程式为___________________。 (4)元素h单质的氧化性强于元素g单质的氧化性的事实是___________(用离子方程式表示)。 |
|
| 20. 推断题 | 详细信息 |
A、B、C、X均为中学化学常见物质,它们之间有如下转化关系(副产物已略去)。 (1)X是空气中存在的强氧化性无色气体单质,则A不是_____(填序号)。 a.C b.Na c.Al d.S 若C是红棕色气体,则A可能是___________或____________。 (2)若X是一种温室气体,单质A被誉为国防金属,则反应①的化学方程式为___________________________________________________。 (3)若X为苛性碱,A是具有臭鸡蛋性气味的气体,则反应②的离子方程式为___________________________________________________。 |
|
| 21. 填空题 | 详细信息 |
|
良好生态环境是最普惠的民生福祉。治理大气污染物CO、NOX、SO2具有十分重要的意义。 (1)氧化还原法消除NOX的转化如下所示:  。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。 。反应I为NO+O3===NO2+O2,其还原产物是_________。反应Ⅱ中,氧化剂与还原剂的物质的量之比为__________。(2)吸收SO2和NO获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。 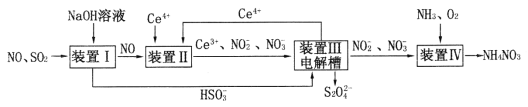 装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式_______________。装置III中发生反应的离子方程式为_________________。 (3)已知进入装置IV的溶液中NO2-的浓度为a mol·L-1,要使1L该溶液中NO2-完全转化为NH4NO3,至少需向装置IV中通入标准状况下的氧气____L(用含a代数式表示)。 |
|
| 22. 实验题 | 详细信息 |
|
在实验室中模拟“侯氏制碱法”,其实验步骤如下: 第一步:连接好装置,检验气密性,在仪器内装入药品。 第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,一段时间后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。 第三步:分离C中所得的混合物,得到NaHCO3固体,进而生产出纯碱。 第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。 (1)下图所示装置的连接顺序是:a接_______,_______接______;b接_______(填接口序号)。 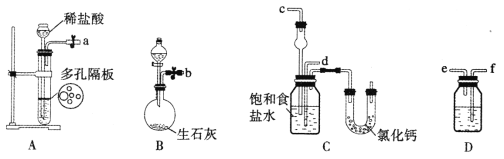 (2)A中常选用的固体反应物为_________;D中应选用的液体为____________。 (3)第二步中让___________装置先发生反应(填装置序号)。 (4)C中用球形干燥管而不用直导管,其作用是____________________;装有无水CaCl2的U形管的作用是__________________________。 (5)第三步分离出NaHCO3固体的操作是__________________________。 (6)第四步中所加固体粉末化学式为___________。所得的晶体中常含有少量的NaCl和NaHCO3(共约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象:____________________________________。 |
|
| 23. 实验题 | 详细信息 |
现要测定某氯化铁与氯化亚铁混合物中铁元素的质量分数。实验按以下步骤进行: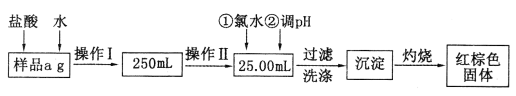 I.根据上面流程,回答以下问题: (1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______(填仪器名称)。 (2)加入氯水发生反应的离子方程式为______________________________。 (3)将沉淀物灼烧后,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温,称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是___________________;若坩埚质量是w1g,坩埚与灼烧后固体总质量是w2g,则样品中铁元素的质量分数是_______________。 II.有同学提出,还可以采用以下方法来测定: 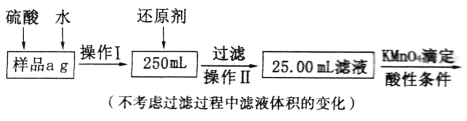 (4)溶解样品改用了硫酸,而不再用盐酸,为什么?_____________________________。 (5)选择的还原剂是否能用铁_____(填“是”或“否”),原因是______________________。 (6))若滴定消耗c mol· L-1KMnO4溶液b mL,则样品中铁元素的质量分数是__________。 |
|
| 24. 计算题 | 详细信息 |
将NaOH、MgCl2、A1C13三种固体组成的混合物溶于足量水后得1.16g白色沉淀。在所得的浊液中逐滴加入1mo1·L-1HC1溶液,加入HC1溶液的体积与生成沉淀的质量关系如图所示,试回答: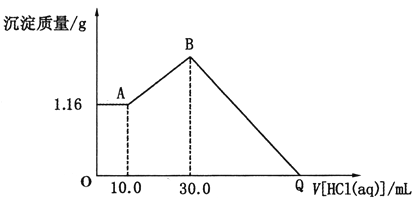 (1)写出混合物溶于水时发生反应的离子方程式:_____________________________。 (2)写出AB段反应的离子方程式:_______________________________。 (3)原混合物中NaOH的物质的量是多少?(写出计算过程) ___________。 |
|
最近更新



