全国2019年高三化学下半年专题练习试卷完整版
| 1. 选择题 | 详细信息 |
|
下列有关说法正确的是 A.储热材料芒硝可用于光-化学能的转换 B.发达国家采用的现代化垃圾焚烧处理法不能有效利用了生活垃圾中的生物质能 C.利用微生物在光合作用下分解水,是氢气制取的一个重要研究方向 D.太阳能、可燃冰资源丰富,在使用时对环境无污染或很少污染,且可以再生,是最有希望的未来新能源 |
|
| 2. 选择题 | 详细信息 |
|
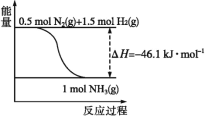
下列关于反应与能量的说法正确的是( ) A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,E反应物<E生成物 B.CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物<E生成物 C.2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJ•mol-1,1molHCl在密闭容器中分解后放出92.3kJ的能量 D.将0.5molN2和1.5molH2置于密闭的容器中充分反应后生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g) |
|
| 3. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 吸热反应一定不能自发进行 B. 由C(s,石墨)=C(s,金刚石)△H=+1.9kJ•mol-1,可知金刚石比石墨稳定 C. S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2( g) △H2,则△H1>△H2 D. 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1,则0.5molH2SO4 与0.5molBa(OH)2反应一定放出57.3kJ热量 |
|
| 4. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1,则H2的燃烧热ΔH=-572 kJ·mol-1 B.500℃、30MPa时,发生反应N2(g)+3H2(g) C.若将等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 D.已知:2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2 |
|
| 5. 选择题 | 详细信息 |
中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如下图所示。 下列说法不正确的是 A. 该催化反应实现了太阳能向化学能的转化 B. 阶段I中,H2O2是氧化产物 C. 每生成1molO2,阶段II中转移电子2 mol D. 反应的两个阶段均为吸热过程 |
|
| 6. 选择题 | 详细信息 |
25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )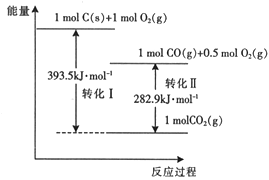 A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1 B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量 C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1 D. CO2(g)分解为C(s)和O2(g)是吸热反应 |
|
| 7. 选择题 | 详细信息 |
|
已知:①2H2(g) + O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1②H2(g) + S(g) =H2S(g) ΔH=-20.1 kJ·mol-1,下列判断正确的是 A. 若反应②中改用固态硫,则1 mol S(s)完全反应放出的热量小于20.1 kJ B. 从焓变数值知,单质硫与氧气相比,更容易与氢气化合 C. 由①②知,水的热稳定性小于硫化氢 D. 氢气的燃烧热为241.8 kJ·mol-1 |
|
| 8. 选择题 | 详细信息 |
|
某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下: S(g)+ H2(g) =H2S(g) Se(g)+H2(g) 下列说法正确的是 A. 稳定性:H2O< H2S< H2Se B. 降温有利于Se与H2反应生成H2Se C. O2(g)+2H2S(g)=2H2O(g)+2S(g) D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生 |
|
| 9. 选择题 | 详细信息 |
|
已知断裂1molH2(g)中的H—H键需要吸收436kJ能量,断裂1molI2(g)中的I—I键需要吸收151kJ能量,生成1molHI(g)中的H—I键能放出299kJ能量。下列说法正确的是( ) A.1molH2(g)和1molI2(g)的总能量为587kJ B.H2(g)+I2(s) C.HI(g) D.I2(g)比H2分子稳定 |
|
| 10. 选择题 | 详细信息 | ||||||||
|
已知:①1mol晶体硅中含有2molSi—Si键。 ②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。 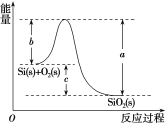 ③
|
|||||||||
| 11. 填空题 | 详细信息 |
|
(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下: Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1 3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1 反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示); (2)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:  ①图中A分别表示______________; ②E的大小对该反应的反应热_________(填“有”或“无”)影响; ③该反应通常用V2O5作催化剂,加V2O5会使图中B点 __________(填“升高”“降低”)。 |
|
| 12. 综合题 | 详细信息 | ||||||||||||
氨在工农业生产中应用广泛。在压强为30MPa时,不同温度时合成氨平衡混合气体中NH3的体积分数如下:
|
|||||||||||||
| 13. 综合题 | 详细信息 | ||||||||||||||||||||||||
|
低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答: (1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g) 
|
|||||||||||||||||||||||||