上海高三化学月考测验(2018年下学期)在线答题
| 1. 选择题 | 详细信息 |
|
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是 A.蒸馏 B.升华 C.干馏 D.萃取 |
|
| 2. 选择题 | 详细信息 |
|
下列说法错误的是 A.SO2可作食品添加剂 B.细铁粉可作食品抗氧剂 C.双氧水可作消毒剂 D.熟石灰可作食品干燥剂 |
|
| 3. 选择题 | 详细信息 |
|
下列化学用语的表述正确的是( ) A. 离子结构示意图 B. 比例模型 C. 氯化铵的电子式为 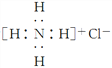 D. CO2的结构式为O—C—O |
|
| 4. 选择题 | 详细信息 |
|
能正确表达下列反应的离子方程式为 A.用醋酸除去水垢:2H++CaCO3 B.硫化亚铁与浓硫酸混合加热:2H++FeS C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32- D.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O |
|
| 5. 选择题 | 详细信息 |
|
下列说法正确的是 A. 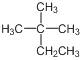 的系统命名为2−甲基−2−乙基丙烷 的系统命名为2−甲基−2−乙基丙烷B.用酸性KMnO4溶液可以确定CH2=CH−CHO中含有C=C双键 C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH D.乙烯和聚氯乙烯都能使溴的四氯化碳溶液褪色 |
|
| 6. 选择题 | 详细信息 |
|
有氯气参加的化学反应一定不属于 A.复分解反应 B.置换反应 C.取代反应 D.加成反应 |
|
| 7. 选择题 | 详细信息 |
|
下列有机化合物中沸点最低的是 A.乙酸乙酯 B.乙酸丁酯 C.甲醛 D.乙酸 |
|
| 8. 选择题 | 详细信息 |
|
下列物质的熔点均按由高到低排列且原因是由于键能由大到小导致的是 A.水、硫化氢 B.碘化氢、溴化氢 C.金刚石、晶体硅 D.钠、干冰 |
|
| 9. 选择题 | 详细信息 |
|
工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2 A.Fe粉与Al2O3可以通过铝热反应制Fe2O3 B.反应中Fe2O3是还原剂 C.3molNa2O2反应,有3mol电子转移 D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
|
| 10. 选择题 | 详细信息 |
|
下列气体通入溶液中一定不会出现浑浊的是 A.CO2通入Ca(OH)2溶液中 B.SO2通入Ba(NO3)2溶液中 C.SO2通入BaCl2溶液中 D.Cl2通入氢硫酸溶液中 |
|
| 11. 选择题 | 详细信息 |
|
下列反应生成物不受反应物的用量或浓度影响的是 A.硝酸银溶液中滴加稀氨水 B.氯化铝溶液中滴加氢氧化钠 C.铁在氯气中燃烧 D.铁粉加入硝酸中 |
|
| 12. 选择题 | 详细信息 |
|
比较C、S元素的非金属性强弱方法错误的是 A.酸性:H2SO4>H2CO3 B.在高温下,碳能将BaSO4还原成BaS C.化合物CS2中S元素显负二价 D.S和H2加热条件下可以化合生成H2S,而C和H2高温条件下很难化合成CH4 |
|
| 13. 选择题 | 详细信息 |
|
已知反应CO(g)+H2O(g) A.升高温度,K增大 B.减小压强,n(CO2)增加 C.更换高效催化剂,CO转化率增大 D.充入一定量的氮气,n(H2)不变 |
|
| 14. 选择题 | 详细信息 |
有关金属的腐蚀与防护的叙述正确的是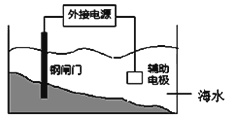 A.金属的化学腐蚀比电化学发生普遍 B.上图装置的原理是“牺牲阳极的阴极保护法” C.金属腐蚀的本质是M-ne-→Mn+而被损耗 D.用铝制铆钉来接铁板,铁板易被腐蚀 |
|
| 15. 选择题 | 详细信息 |
如图是常温下部分短周期元素,最高价氧化物对应水化物的等物质的量浓度稀溶液的pH值与原子序数的关系图,其中H的氧化物是两性氧化物。下列说法正确的是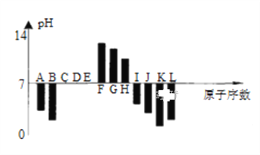 A. 元素B对应的氢化物比J对应的氢化物熔沸点更高,原因是B的氢化物中的键能比J中的大。 B. 根据图形分析可知,K、L两种元素最高价氧化物对应的水化物的酸性,前者较强。 C. 晶体IC2熔化时克服的化学键和晶体KC2与水反应时克服的化学键,类型相同。 D. 元素K、H、G分别形成的简单离子的半径逐渐减少 |
|
| 16. 选择题 | 详细信息 |
|
下列有关实验正确的是 A.装置用于Na2SO3和浓H2SO4反应制取少量的SO2气体 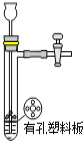 B.装置用于灼烧CuSO4·5H2O 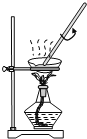 C.装置用于收集氯气并防止污染空气 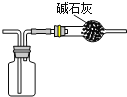 D.装置用于实验室制备少量乙酸乙酯 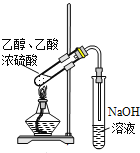 |
|
| 17. 选择题 | 详细信息 | ||||||||||||||||||||
下列除杂方案错误的是( )
|
|||||||||||||||||||||
| 18. 选择题 | 详细信息 |
乙酰水杨酸是一种常见的解热镇痛药,结构简式如图所示。下列有关叙述正确的是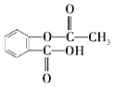 A.乙酰水杨酸的分子式为C9H10O4 B.乙酰水杨酸的含氧官能团有三种 C.能与NaHCO3溶液反应的官能团有一种 D.烃基(−C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体 |
|
| 19. 选择题 | 详细信息 |
|
下列有关电解质溶液的说法正确的是 A. KCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 B. 向氟化钠溶液中加入适量氢氟酸,得到的酸性混合溶液:c(Na+)>c(F-)>c(H+)>c(OH-) C. 25℃时,等体积pH=3的HA和HB两种酸分别与足量的锌反应,相同时间内HA与Zn反应生成的氢气更多,HA是弱酸 D. Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
|
| 20. 选择题 | 详细信息 |
|
某溶液只含有下列离子:NH4+、Na+、Fe2+、NO3-、I−、 SO32-、AlO2-中的四种(忽略水的电离),且各离子的物质的量浓度相等,现进行如下实验: ①取少量该溶液加NaOH溶液共热,产生刺激性气味的气体,未观察到其它明显现象; ②取少量该溶液加足量的硝酸,可观察到红棕色气体,未观察到沉淀生成。 根据上述实验,下列说法正确的是() A.根据实验①只能确定原溶液中一定有 B.取实验②后的溶液滴加淀粉溶液变蓝色 C.原溶液中可能含有NH4+、Na+、SO32-、I−四种离子 D.取少量原溶液加酸性高锰酸钾溶液,可能有两种离子被氧化 |
|
| 21. 综合题 | 详细信息 | ||||||||||||
|
汽车尾气中的主要污染物为NOx、CO等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。 I.催化剂存在时用H2将NO还原为N2。 已知: 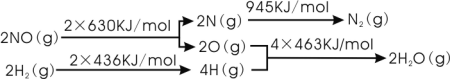 则H2还原NO生成氮气和水蒸气的热化学方程式是:______________________________。 II.用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g)
|
|||||||||||||
| 22. | 详细信息 | ||||||||||||||||||||
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下: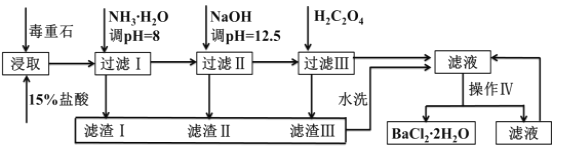
|
|||||||||||||||||||||
| 23. 综合题 | 详细信息 | ||||||
|
二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题: I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。 (1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。 (2)使用双氧水作还原剂的优点是_________________________________________。 II.当pH≤2.0时,NaClO2能被I− 完全还原成Cl−;(离子反应方程式为ClO2−+4H++4I−→2I2+Cl−+2H2O)。回答下列问题: 溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
|
|||||||
| 24. 综合题 | 详细信息 |
聚合物F的合成路线图如图: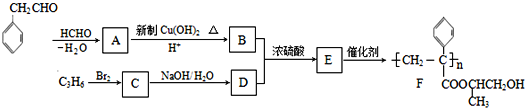 已知:HCHO+RCH2CHO 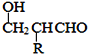 请据此回答: (1)A中含氧官能团名称是________________,C的系统命名为_____________________ 。 (2)检验B中所含官能团所用的试剂有______________、_____________;E→F的反应类型是______________,B+D (3)写出A→B的化学方程式__________________________________________________。 (4)写出C→D的化学方程式__________________________________________________。 (5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 |
|



