四川省巴中中学、南江中学2020-2021年高一上半期期末联考化学免费试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生产和生活等密切相关,下列说法错误的是( ) A.漂粉精、臭氧、二氧化氯可用于游泳池的消毒 B.明矾和FeCl3可用于自来水的净化 C.木材、纺织品等用水玻璃侵泡后即耐腐蚀又不易着火 D.大量排放二氧化碳气体可导致酸雨 |
|
| 2. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A.除去MgCl2溶液中混有的FeCl2溶液工业上一般先将Fe2+氧化为Fe3+再以Fe(OH)3除去,因为Fe(OH)2为白色絮状沉淀不易过滤。 B.向饱和的FeCl3溶液中加入适量的NaOH溶液并加热至溶液呈红褐色,可以制得Fe(OH)3胶体 C.向饱和的NaHCO3溶液中滴加酚酞,溶液呈浅红色是因为 D.铝箔用砂纸仔细打磨,除去表面的保护膜,在酒精灯上加热会观察到铝受热融化并滴落 |
|
| 3. 选择题 | 详细信息 |
某试剂瓶标签上安全标志如图,该试剂是( )  A. 氨水 B. 乙酸 C. 氢氧化钠 D. 硝酸 |
|
| 4. 选择题 | 详细信息 |
|
现有三组溶液:①氯化钠和单质溴的水溶液,②45%的乙醇溶液,③煤油和氯化钠溶液,分离以上各混合液的正确方法依次是( ) A.分液、萃取、蒸馏 B.萃取、蒸馏、分液 C.分液、蒸馏、萃取 D.蒸馏、萃取、分液 |
|
| 5. 选择题 | 详细信息 |
|
下列我国古代的技术应用中,不涉及氧化还原反应的是 A.火药使用 B.转轮排字 C.湿法炼铜 D.粮食酿酒 |
|
| 6. 选择题 | 详细信息 |
图为人教版高中化学必修一教材中“NaCl固体在水中的溶解和形成水合离子示意图”。下列有关说法错误的是( ) A.上述过程可表示为NaCl=Na++Cl- B.水分子破坏了Na+和Cl-之间的相互作用,在形成的水合钠离子和水合氯离子中水分子的朝向不同 C.NaCl只有在水溶液中才能发生电离 D.在NaCl固体中,Na+和Cl-有序排列 |
|
| 7. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列关于物质分类的组合正确的是( )
A.A B.B C.C D.D |
||||||||||||||||||||||||||
| 8. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数,下列说法是正确的是( ) A.常温常压下,14 g由N2与CO组成的混合物气体含有的原子数目为NA B.30 g SiO2中含有硅氧键个数为NA C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA D.2 L 0.5 mol·L-1硫酸溶液中含有的氧原子数为4NA |
|
| 9. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是( ) A.向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓ B.将磁性氧化铁溶于盐酸中:Fe3O4+8H+=3Fe3++4H2O C.1 mol·L-1NaAlO2溶液和2.5 mol·L-1HCl溶液等体积混合:2 D.Fe(OH)3和HI的反应:Fe(OH)3+3H+=Fe3++3H2O |
|
| 10. 选择题 | 详细信息 |
|
用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是( ) ①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液 A.②③④③ B.①⑥⑤③ C.②③⑤③ D.①③⑤③ |
|
| 11. 选择题 | 详细信息 | |||||||||||||||
下列对事实的解释不正确的是
|
||||||||||||||||
| 12. 选择题 | 详细信息 |
|
关于金属钠单质及其化合物的说法中,不正确的是( ) A. NaCl可用作食品调味剂 B. 相同温度下NaHCO3溶解度大子Na2CO3 C. Na2CO3的焰色反应呈黄色 D. 工业上Na可用于制备钛、锆等金属 |
|
| 13. 选择题 | 详细信息 |
|
“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是( ) A.玻璃是人类最早使用的硅酸盐制品 B.制水泥的原料为纯碱、石灰石和石英 C.硅酸盐制品的性质稳定、熔点较高 D.沙子和黏土的主要成分均为硅酸盐 |
|
| 14. 选择题 | 详细信息 |
向稀硫酸和稀硝酸的混合溶液200 mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是( ) A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 B.A点溶液中的溶质为FeSO4和H2SO4 C.原混合酸中NO D.原混合酸中H2SO4的物质的量浓度为2 mol·L-1 |
|
| 15. 选择题 | 详细信息 |
|
二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用于饮用水消毒。下列有关ClO2的制备与杀菌的说法合理的是( ) A.ClO2在强碱性环境中使用失效,可能的原因是2ClO2+2OH-= B.可用饱和食盐水除去ClO2中的NH3 C.NaClO2在酸性条件下歧化生成ClO2和NaCl,则n(氧化剂)∶n(还原剂)=4:1 D.等质量的ClO2杀菌效果比Cl2弱 |
|
| 16. 选择题 | 详细信息 |
保险粉(Na2S2O4),易被氧气氧化。利用如图装置,在锥形瓶中加入HCOONa、NaOH、CH3OH(溶剂)和水形成的混合液,通入SO2时发生反应生成保险粉和一种常见气体,下列说法正确的是( ) A.制备保险粉的离子方程式为:HCOO-+H2O+2SO2=S2O B.为避免产生的Na2S2O4被O2氧化,使硫酸与亚硫酸钠先反应,产生的SO2排出装置中的空气 C.制备SO2气体所用的浓硫酸应该换为98%H2SO4 D.NaOH溶液的主要作用是吸收逸出的CO2 |
|
| 17. 填空题 | 详细信息 |
|
分类法是学习化学最重要的方法之一。 Ⅰ.现有以下物质:①H2O ②Fe ③CaCO3 ④Fe(OH)3胶体 ⑤乙醇 ⑥CO ⑦稀硫酸 (1)以上物质中属于混合物的是___________(填序号,下同),能导电的有____________,属于电解质的是________。 (2)向④中逐滴滴加⑦,可观察到的现象是______________。 Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。 (3)图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是________(填字母)。  (4)有同学认为所有酸碱中和反应均可表示为H++OH-=H2O。请举个例子反驳上述观点(用离子方程式表示)________________________。 (5)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2X+2H2O。则X的化学式是___________。 |
|
| 18. | 详细信息 |
物质的类别和元素的价态是学习元素及其化合物性质的两个重要认识视角。下列分别为钠和氯及其化合物的“价-类”二维图,请回答下列问题: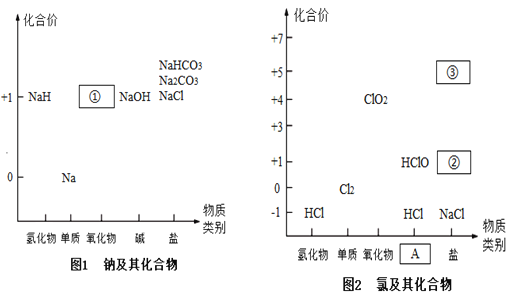 (1)NaH中H的化合价为______,NaH用作生氢剂时和水反应的化学方程式为:____。 (2)物质③常用于实验室制取O2,则③的名称是_________________。 (3)从物质类别角度看,NaHCO3属于________,从化合价角度看,HClO具有__________(填“还原性”或“氧化性”或“既有氧化性又有还原性”),已知HClO与Na2SO3溶液反应有Na2SO4生成,该反应中氧化剂和还原剂的物质的量之比为___________。 (4) 舍勒发现氯气的实验至今仍是实验室制氯气的主要方法,请写出该方程式:_________ |
|
| 19. 填空题 | 详细信息 |
|
铁和钙是人类生命活动所必需的元素,利用相关知识,完成下列问题。 Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________(填字母,下同)。 A.Fe B.FeSO4 C.Fe3O4 (2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是__________。 A.NaNO2被氧化 B.药品美蓝是还原剂 C.NaNO2是还原剂 D.药品美蓝被还原 (3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:__________________________________________________。 Ⅱ.人体血液里Ca2+的浓度一般采用m g·cm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。 (配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。   (4)请你观察图示判断其中不正确的操作有________(填序号)。 (5)其中确定50 mL溶液体积的容器是________(填名称)。 (6)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将________(填“偏大”或“偏小”)。 (测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗9.00 mL KMnO4溶液。 (7)已知草酸与KMnO4反应的离子方程式为:____________________________________。 (8)经过计算,血液样品中Ca2+的浓度为________ mg·cm-3。 |
|
| 20. 实验题 | 详细信息 |
某同学在实验室探究硝酸的制备和性质,设计了如图所示装置。 (1)某同学想用下列装置及试剂方便快速地制取少量氨气。 化学试剂:①NH4Cl固体、②浓氨水、③CaO固体。 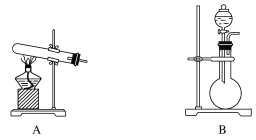 应选择的装置是______(填字母),选用的试剂是______(填序号)。 简述快速制取氨气的原理___________。 实验过程中,制气时的实验操作是_________。 (2)乙装置的作用是______;写出受热时丙装置中发生反应的化学方程式:____。 (3)当戊中观察到_______现象,则说明已制得硝酸。某同学按上图组装仪器并检验装置气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因是:____,如何改进装置:___________。 (4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是_____。 |
|
最近更新



