普通高中高二化学2018年下半年月考测验带参考答案与解析
| 1. 选择题 | 详细信息 |
|
天然气是目前推广使用的清洁燃料,它的主要成分是: A. CO B. H2 C. CH4 D. CH3OH |
|
| 2. 选择题 | 详细信息 |
|
下列气体中,对人体无毒害作用的是: A. Cl2 B. SO2 C. NO2 D. O2 |
|
| 3. 选择题 | 详细信息 |
贴有图所示标志的槽罐车内可能装有: A. 液氯 B. 汽油 C. 浓硫酸 D. 四氯化碳 |
|
| 4. 选择题 | 详细信息 |
|
用激光笔照射烧杯中的豆浆时,可看见一条光亮的“通路”,该豆浆属于: A. 悬浊液 B. 乳浊液 C. 胶体 D. 溶液 |
|
| 5. 选择题 | 详细信息 | ||||||||||
实验室里的药品是分类存放的。现有一瓶稀盐酸,应放入下列哪个药品柜( )
|
|||||||||||
| 6. 选择题 | 详细信息 |
|
下列各组微粒,互称为同位素的是: A. |
|
| 7. 选择题 | 详细信息 |
|
下列有机物中,不属于烃类的是( ) A. CH3CH3 B. C6H6 C. CH2===CH2 D. CH3COOH |
|
| 8. 选择题 | 详细信息 |
|
芯片是各种计算机、手机和微电子产品的核心部件,它的主要材料是: A. Si B. SiO2 C. H2SiO3 D. Na2SiO3 |
|
| 9. 选择题 | 详细信息 |
|
向盛有Fe2(SO4)3溶液的试管中滴入几滴KSCN溶液后,溶液呈: A. 无色 B. 黄色 C. 红色 D. 浅绿色 |
|
| 10. 选择题 | 详细信息 |
|
在溶液中,下列离子能与CO32-大量共存的是: A. H+ B. Na+ C. Ca2+ D. Ba2+ |
|
| 11. 选择题 | 详细信息 |
|
反应2Na +2H2O=2NaOH+H2↑中的还原剂是( ) A. Na B. H2O C. NaOH D. H2 |
|
| 12. 选择题 | 详细信息 |
|
从海水资源中提取下列物质,不用化学方法可能得到的是( ) A. Mg B. Br2 C. I2 D. NaCl |
|
| 13. 选择题 | 详细信息 |
|
下列物质中,不能发生水解反应的是: A. 葡萄糖 B. 蔗糖 C. 油脂 D. 纤维素 |
|
| 14. 选择题 | 详细信息 |
|
下列有关物质用途的叙述中,错误的是( ) A. 氧化铝可用于制造耐火坩埚 B. 二氧化硫可用来漂白食品 C. 氧化铁可用作红色油漆和涂料 D. 硅酸钠溶液可用作木材防火剂 |
|
| 15. 选择题 | 详细信息 |
|
为探究Al(OH)3的性质,某同学取两支洁净的试管,加入适量Al(OH)3悬浊液,然后分别滴加足量的:①稀盐酸;②NaOH溶液。下列有关实验现象的描述正确的是: A. ①、②都澄清 B. ①、②都浑浊 C. ①澄清,②浑浊 D. ①浑浊,②澄清 |
|
| 16. 选择题 | 详细信息 |
|
下列金属的冶炼方法中,属于热还原法的是( ) A. 2Ag2O C. Fe2O3+3CO |
|
| 17. 选择题 | 详细信息 |
|
硫酸工业的重要反应之一:2SO2(g)+O2(g) A. 升高温度,反应速率加快 B. 使用合适的催化剂,反应速率加快 C. 平衡时,SO2的转化率为100% D. 平衡时,SO3的浓度不再改变 |
|
| 18. 选择题 | 详细信息 |
|
下列反应中,属于加成反应的是( ) A. CH2===CH2+H2 C. CH3CH2OH+3O2 |
|
| 19. 选择题 | 详细信息 |
|
下列化学用语表述正确的是( ) A. 含有2个中子的氢原子:21H B. Na的原子结构示意图:  C. HCl的电子式: |
|
| 20. 选择题 | 详细信息 |
下图为氢氧燃料电池装置示意图,下列有关说法正确的是( )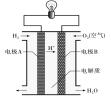 A. 电极A为正极 B. 产物为水,属于环境友好电池 C. 电子流向:电极B→导线→电极A D. 该电池的化学能可以100%转化为电能 |
|
| 21. 选择题 | 详细信息 |
|
下列离子方程式中,正确的是: A. 铁片插入稀盐酸中:2Fe+6H+===2Fe3++3H2↑ B. 稀硝酸滴在石灰石上:2H++CO32-===H2O+CO2↑ C. 氯气通入氯化亚铁溶液中:Cl2+Fe2+===2Cl-+Fe3+ D. 氯化钡溶液滴入硫酸钠溶液中:Ba2++SO42-===BaSO4↓ |
|
| 22. 选择题 | 详细信息 |
|
关于1 mol H2O的下列说法中,错误的是(NA表示阿伏加德罗常数的值): A. 质量为18 g B. 含氧原子数为NA C. 含电子数为10NA D. 标准状况下的体积为22.4 L |
|
| 23. 填空题 | 详细信息 |
|
化学是一门实用性很强的科学。根据题意填空: (1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g) (2)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素; (3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。 |
|
| 24. 填空题 | 详细信息 |
乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化: 请根据题意填空: (1)CH3COOH的官能团为________(填“羟基”或“羧基”); (2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”); (3)完成B→C的化学方程式:2CH3CH2OH+O2 |
|
| 25. 实验题 | 详细信息 |
某学习小组为了探究碳与浓H2SO4反应的产物,将浓H2SO4和木炭反应产生的气体进行以下实验: (1)气体通过无水硫酸铜,固体变蓝。说明气体中含有__________; (2)气体通入品红溶液,溶液褪色;微热,溶液恢复红色。说明气体中含有__________(填“SO2”或“CO2”); (3)气体通入足量的澄清石灰水,产生白色沉淀。该小组认为气体中含有CO2,你认为该结论:__________(填“正确”或“不正确)。 |
|
| 26. 填空题 | 详细信息 |
下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题: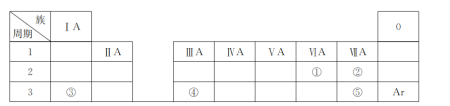 (1)①的元素符号是________; (2)②和⑤的原子半径大小关系是②________⑤(填“>”“<”或“=”); (3)③和⑤形成的化合物含有的化学键是__________(填“离子键”或“共价键”); (4)③、④的最高价氧化物对应的水化物相互反应的离子方程式为_________________________。 |
|
| 27. 实验题 | 详细信息 |
|
在实验室里,常用如图所示装置制取并收集氨气。请回答下列问题: (1)原理与方法 ①制取氨气的化学方程式为__________________________________; ②该收集氨气的方法为________。 A.向上排空气法 B.向下排空气法 (2)装置与操作 按下图组装仪器,进行实验。仪器a的名称为____________。 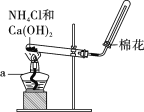 (3)思考与交流 ①欲制取标准状况下4.48 L NH3,至少需要NH4Cl________g; ②实验室制取氨气,还可采用下图中的______(填“A”或“B”)。  |
|
| 28. 综合题 | 详细信息 |
|
(1)树立健康观念,促进身心健康全面发展。现有下列四种物质: A.淀粉 B.油脂 C.氨基酸 D.阿司匹林 请回答下列问题(填字母代号): ①具有解热镇痛作用,为人们熟知的治感冒药是________; ②蛋白质是生命的基础,它在酶的作用下水解最终生成________; ③能在体内水解,且最终转化为葡萄糖的天然高分子化合物是________; ④为增进食欲,保证机体正常的生理功能,常在烹制食物时添加________。 (2)材料是人类赖以生存和发展的重要物质。请回答下列问题: ①生铁和钢是含碳量不同的两种铁碳合金。其中含碳量较低的是________; A.生铁 B.钢 ②钢铁容易发生腐蚀,在生产和生活中比较普遍的腐蚀是________; A.化学腐蚀 B.电化学腐蚀 ③我们常说的三大合成材料是____________、合成纤维和合成橡胶。 (3)我们与地球相依为命。请回答下列问题: ①汽车在给人们带来出行方便的同时,排出了大量的污染物。以下排出物中不属于大气污染物的是________; A.CO B.CO2 C.NOx ②党的“十九大”进一步要求,环境保护要和经济协调发展。下列做法不符合这一要求的是________; A.尽量减少使用塑料袋 B.积极开展垃圾分类和回收利用 C.将工业废水用暗管排入河流中 ③利用沉淀反应可以除去水中的重金属离子。例如,向含有Cd2+的废水中加入Na2S,可以将Cd2+沉淀除去。请写出该反应的离子方程式____________________________________________________。 |
|
| 29. 综合题 | 详细信息 |
|
(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol 试回答下列问题: ①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”); ②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。 (2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g) ①5秒内,v(NO2)=__________mol/(L·s); ②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”); ③该反应的平衡常数表达式K=________________。 (3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡: HSO3-=H++SO32- Ka2 HSO3-+H2O=H2SO3+OH- Kh2 已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液: ①溶液呈__________(填“酸性”“碱性”或“中性”); ②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。 (4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。  ①几分钟后,可观察到导管中的水柱________; A.升高 B.降低 ②水柱变化的原因是铁钉发生了电化学腐蚀中的________; A.析氢腐蚀 B.吸氧腐蚀 ③该电化学腐蚀的正极反应式为__________________________________。 |
|
最近更新



