上海市高三化学高考模拟(2019年下学期)试卷完整版
| 1. | 详细信息 |
|
我国导航卫星的“心脏”使用的是铷原子钟,下列关于铷的说法正确的是 A. 85Rb和87Rb互称为同素异形体 B. 86Rb和87Rb具有相同的中子数 C. |
|
| 2. | 详细信息 |
|
下列说法错误的是( ) A. 发展太阳能发电、利用CO2制造全降解塑料都能有效减少环境污染 B. 从2019年7月1日起我国全面实施垃圾分类,提高废品回收率,减少对环境影响 C. 绿色化学又称“环境无害化学”、“环境友好化学”、“清洁化学” D. 石油裂化、裂解为化学变化,而煤的气化和石油的分馏均为物理变化 |
|
| 3. | 详细信息 |
|
目前世界上有近20亿的人患有缺铁性贫血。这里的“铁”是指 A. 铁单质 B. 铁元素 C. 氧化铁 D. 铁合金 |
|
| 4. | 详细信息 |
|
下列有关氮元素的化学用语中正确的是 A. 氮分子的结构式:N≡N B. 氮原子最外层的电子云图: C. NH3的球棍模型: |
|
| 5. | 详细信息 |
|
某古玩爱好者收藏的“商代铝碗”在“鉴宝”时被专家当场否定,其理由是 A. 铝的导热性较强,不易做碗 B. 铝的质地较软,易变形,不易做碗 C. 铝元素易导致老年痴呆,不易盛放食物 D. 铝的性质较活泼,难提炼,商代不可能有铝制品 |
|
| 6. | 详细信息 |
|
下列物质属于电解质的是 A. 盐酸 B. 纯碱 C. 液氯 D. 酒精 |
|
| 7. | 详细信息 |
常温下,将SO2气体逐渐通入某溶液,溶液的pH值随通入的SO2气体体积的变化如图所示,该溶液可能是 A. 氯水 B. 氨水 C. 氢硫酸 D. 食盐水 |
|
| 8. | 详细信息 |
|
不能比较硫和氧非金属性相对强弱的是 A. 热稳定性:H2O>H2S B. SO2中S为+4价,O为-2价 C. 沸点:H2O>H2S D. 硫在氧气中燃烧生成二氧化硫 |
|
| 9. | 详细信息 | ||||||
短周期非金属元素甲~戊在元素周期表中位置如表所示,分析正确的是
|
|||||||
| 10. | 详细信息 |
|
只用滴管和试管,不用其它仪器和试剂,不能鉴别下列各组中两种溶液的是 A. 石灰水和碳酸钠 B. 盐酸和碳酸钠 C. 氨水和硝酸银 D. 氢氧化钠和氯化铝 |
|
| 11. | 详细信息 |
|
关于晶体的叙述中,正确的是 A. 分子晶体中,共价键的键能越大,熔、沸点越高 B. 分子晶体中,分子间的作用力越大,该分子越稳定 C. 原子晶体中,共价键的键能越大,熔、沸点越高 D. 某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
|
| 12. | 详细信息 |
|
在pH=13的某溶液中存在大量的Na+、ClO-、NO3-,该溶液还可能大量存在的离子是 A. NH4+ B. HCO3- C. SO42- D. Al3+ |
|
| 13. | 详细信息 |
|
下列属于加成反应的是 A. 乙苯与液溴在铁的催化下反应 B. 乙炔在空气中燃烧 C. 甲烷与氯气在光照条件下反应 D. 乙烯使溴的四氯化碳溶液褪色 |
|
| 14. | 详细信息 |
|
将碳棒和铁棒平行插入NaCl溶液中,两棒的液面以上部分用铜丝相连、并接入电流计,电流计指针偏转。以下说法正确的是 A. 碳棒作负极 B. 电子自铁棒通过铜丝流向碳棒 C. 该装置是电解池 D. 铜丝失去电子发生还原反应 |
|
| 15. | 详细信息 |
|
有机物命名正确的是 A. 2,3,5-三甲基己烷 B. 1,3-二甲基丁烷 C. 2,3-二甲基-2-乙基己烷 D. 2,3-二甲基-4-乙基戊烷 |
|
| 16. | 详细信息 |
|
只改变一个影响因素,下列关于平衡常数K的叙述错误的是 A. K值不变,平衡可能移动 B. K值变化,平衡一定移动 C. 温度变化,K值一定变化 D. 平衡移动,K值一定变化 |
|
| 17. | 详细信息 |
|
下列实验操作正确的是 A. 测pH值时,用干燥洁净的玻璃棒蘸取溶液点在pH试纸上,再跟标准比色卡比较 B. 滴定管经蒸馏水洗后即可加入标准液进行滴定 C. 用带橡皮塞的棕色细口瓶盛放液溴 D. 配制溶液时,若加水时不小心超过容量瓶的标线,可用滴管把多余的液体吸出 |
|
| 18. | 详细信息 |
已知断开1molH2(g)中H-H键需要吸收436kJ能量,根据能量变化示意图,下列说法或热化学方程式不正确的是( ) A. 断开1molHCl(g)中H-Cl键要吸收432kJ能量 B. 生成1molCl2(g)中的Cl-Cl键放出243kJ能量 C. HCl(g)→1/2H2(g)+1/2Cl2(g)-92.5kJ D. H2(g)+Cl2(g)→2HCl(g)+864kJ |
|
| 19. | 详细信息 |
|
某无色溶液中可能存在Br-、CO32-、SO32-、Fe3+、I-、Mg2+、Na+等例子中的某几种,现取该溶液进行实验,得到如下现象: ①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出; ②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成; ③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。 据此可以推断:该溶液肯定不存在的大量离子是 A. Fe3+、SO32-、I- B. Mg2+、CO32-、I- C. Fe3+、Mg2+、SO32- D. Na+、Br-、CO32- |
|
| 20. | 详细信息 |
|
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为 A. 78 B. 140 C. 156 D. 172 |
|
| 21. | 详细信息 | ||||||||||||||||||||
我国自主研制的C919大型客机的机身大量采用第三代铝锂合金减重并提高刚度。某铝锂合金成分(质量百分比)如下(Bal指剩余的百分含量):
|
|||||||||||||||||||||
| 22. | 详细信息 |
|
工业上,在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氢气和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g) (1)一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=___________________。可从混合气体的颜色变化判断上述反应是否达到平衡,其理由是_______________________________________________。 (2)工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4,(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比____2:1(选填“>”、“<”、“=”),用离子方程式解释其原因______________________。 (3)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2+HCl→ClO2↑+NaCl+_____(没有配平) (4)补全方程式并配平,标出电子转移方向和数目_________________________ 。 (5)该反应中氧化剂和还原剂的物质的量之比是___________。若生成0.2molClO2,转移电子数为_____个。 |
|
| 23. | 详细信息 |
功能高分子P的合成路线如下,其中反应⑥发生了加聚反应。 请回答下列问题: (1)A的结构简式为____________________,试剂a是_______________________。 (2)反应②的反应类型是___________,E中含有的官能团有___________________。 (3)反应⑥的条件是____________________________。 (4)写出E的一种具有六元环酯的同分异构体的结构简式___________________。 (5)写出由乙苯制取对溴苯乙烯( |
|
| 24. | 详细信息 |
醋酸亚铬[(CH3COO)2Cr∙H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬(溶液呈绿色)还原为二价铬(溶液呈亮蓝色);二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如下,请回答以下问题: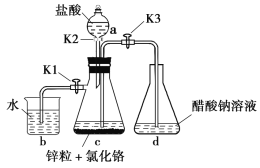 (1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是___________________,仪器a的名称是___________。 (2)将过量的锌和氧化铬固体置于c中,加入少量蒸馏水,按图连接好,打开K1、K2,关闭K3。此时观察到c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_____________________;过量锌的作用是______________________________________________。 (3)打开K3,关闭K1、K2,观察到现象为___________________________、d中出现砖红色沉淀,为得到纯净的砖红色晶体,需采取的操作是__________、__________、洗涤、干燥。 (4)装置d可能存在的缺点为_________________________________________________。 |
|
最近更新



