2019-2020年高三前半期期中考试化学题免费试卷(上海市市东中学)
| 1. 选择题 | 详细信息 |
|
下列对化学反应本质的认识,错误的是 A.原子一定重新组合 B.一定有电子转移 C.有旧键断裂和新键形成 D.必然伴随着能量的变化 |
|
| 2. 选择题 | 详细信息 |
|
下列各组数据比较,前者比后者小的是 A.氯水与氨水中微粒种类 B.乙烷与苯分子中碳碳键键长 C.氯化铯与氯化钠的熔点 D.Al2O3与AlCl3的熔点 |
|
| 3. 选择题 | 详细信息 |
秸秆、稻草等生物质是一种污染小的可再生能源,其主要转化途径及主要产物如图。下列有关说法错误的是( )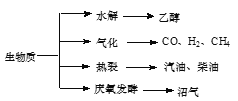 A.生物质能所含能量本质上来源于太阳能 B.由秸秆等物质水解获得的乙醇属生物质能 C.生物质裂解获得的汽油、柴油等属于纯净物 D.由秸杆稻草等发酵获得的沼气,主要成分是甲烷 |
|
| 4. 选择题 | 详细信息 |
|
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是 ( ) A. 范德华力、范德华力、范德华力 B. 范德华力、范德华力、共价键 C. 范德华力、共价键、共价键 D. 共价键、共价键、共价键 |
|
| 5. 选择题 | 详细信息 |
|
不能用于比较Na与Al金属性相对强弱的事实是 A.Na和AlCl3溶液反应 B.最高价氧化物对应水化物的碱性 C.单质与H2O反应的难易程度 D.同浓度NaCl和AlCl3溶液的pH |
|
| 6. 选择题 | 详细信息 |
|
实验室制取下列物质的实验中未利用冷凝原理的是 A.乙酸乙酯 B.乙酸丁酯 C.溴乙烷 D.乙烯 |
|
| 7. 选择题 | 详细信息 | |||||||||
已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
|
||||||||||
| 8. 选择题 | 详细信息 |
|
常温下加入下列物质,能使溶液中c(CO32-)、c(HCO3-)均降低,而pH增大的是 A.氢氧化钠溶液 B.通入二氧化碳 C.氢氧化钙溶液 D.盐酸 |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是 A. 分子晶体中一定存在分子间作用力,不一定存在共价键 B. 分子中含两个氢原子的酸一定是二元酸 C. 含有金属阳离子的晶体一定是离子晶体 D. 元素的非金属型越强,其单质的活泼性一定越强 |
|
| 10. 选择题 | 详细信息 |
|
在海轮的船壳上连接锌块,下列相关说法正确的是 A.制成合金保护船体 B.是外加电流的阴极保护法 C.船体的反应:Fe -2e—=Fe2+ D.锌块的反应:Zn -2e—=Zn2+ |
|
| 11. 选择题 | 详细信息 |
|
在25℃时,有80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末ag,反应后温度恢复到25℃,下列有关该溶液的说法正确的是( ) A.溶液中c(Ba2+)将增大 B.溶液的pH将增大 C.溶液中Ba2+的物质的量将减少 D.溶液中c(OH-)减少 |
|
| 12. 选择题 | 详细信息 |
|
常温下0.1 mol/L醋酸溶液的pH = a,下列能使溶液pH =(a +1)的措施是 A.将溶液稀释到原体积的10倍 B.加入适量的醋酸钠固体 C.加入等体积0.1 mol/L烧碱溶液 D.加入等体积0.1 mol/L盐酸 |
|
| 13. 选择题 | 详细信息 |
|
25 ℃时,水的电离达到平衡:H2O A. 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 C. 向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低 D. 将水加热,Kw增大,pH不变 |
|
| 14. 选择题 | 详细信息 |
观察如图装置,下列说法正确的是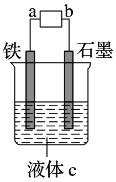 A. a、b接电流表,该装置为原电池 B. a、b接直流电源,该装置为电解池 C. a、b接直流电源,铁可能不易被腐蚀 D. a、b接电流表或接直流电源,铁都可能是负极 |
|
| 15. 选择题 | 详细信息 |
有机物M的结构如图所示。关于M的描述正确的是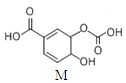 A.分子式为C8H6O6 B.能发生中和、取代、消去、氧化、加成反应 C.1 molM与溴水发生反应的产物可能有3种 D.1molM与足量氢氧化钠溶液反应,消耗4molNaOH |
|
| 16. 选择题 | 详细信息 | ||||||||||
|
由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol 晶体硅的热效应是
|
|||||||||||
| 17. 选择题 | 详细信息 |
|
某溶液中含有下列离子中的五种:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3–、CO32–、Cl–、NO3–、SO42–,浓度均为0.1mol/L。向其中加入足量的盐酸,有气体生成且反应后溶液中阴离子的种类没有变化。以下分析错误的是 A.原溶液中不含HCO3–和CO32– B.向加盐酸后的溶液中再加KSCN溶液,显红色 C.能确定原溶液中的五种离子 D.原溶液中有三种阳离子和两种阴离子 |
|
| 18. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是 A. 次氯酸钙中通入过量二氧化碳:Ca2++2C1O-+H2O+CO2=CaCO3↓+2HClO B. 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3+ +4H2O C. 用氨水吸收少量二氧化硫:NH3·H2O+SO2=NH4++HSO3- D. 硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O= Fe(OH)3↓+3NH4+ |
|
| 19. 选择题 | 详细信息 |
|
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是 A.三种酸的电离常数:Ki1(H2CO3) > Ki(HX) > Ki(HY) > Ki2(H2CO3) B.NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) C.同浓度溶液的碱性:NaX > Na2CO3 > NaY > NaHCO3 D.结合H+的能力:Y- > CO32- > X- > HCO3- |
|
| 20. 综合题 | 详细信息 |
|
二氧化氯(ClO2)是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代品。工业上制备ClO2的方法很多,NaClO3 和NaClO2是制取ClO2的常见原料。完成下列填空: (1)以下反应是制备ClO2的一种方法:H2C2O4+2NaClO3+H2SO4→Na2SO4+2CO2↑+2ClO2↑+2H2O 上述反应物中属于第三周期元素的原子半径大小顺序是___;其中原子半径最大元素的原子,其核外电子排布式为___,其核外有___种不同能量的电子。 (2)ClO2的分子构型为“V”形,则ClO2是___(选填“极性”、“非极性”)分子,其在水中的溶解度比氯气___(选填“大”、“小”、“一样”)。 (3)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,ClO2的消毒能力是等质量Cl2的___倍(保留2位小数)。 (4)若以NaClO2为原料制取ClO2,需要加入具有___(填“氧化”、“还原”)性的物质。 (5)工业上制取NaClO3通过电解法进行,电解时,不同反应环境下的总反应分别为: 4NaCl +18H2O→4NaClO3+3O2↑+18H2↑(中性环境) NaCl +3H2O→NaClO3 +3H2↑(微酸性环境) ①电解时,氢气在___极产生。 ②更有利于工业生产NaClO3的反应环境是___,理由__。 |
|
| 21. 填空题 | 详细信息 |
|
Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。完成下列填空: (1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___。 (2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式___。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是___。 向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。 (3)反应过程中,溶液的pH逐渐___(填“变大”、“变小”),生成的沉淀是___; (4)关于反应后得到的溶液,下列离子浓度关系正确的是___。 a.c(Na+)=c(S2O32-) +2c(HSO3-)+2c(H2SO3) + 2c(HS-) b.c(Na+)+c(H+)=2c(S2O32-)+c(HSO3-) +c(HS-) +c(OH-) c.c(Na+)=2c(HS-) d.c(Na+)=2c(HS-)+2c(S2O32-)+c(HSO3-) |
|
| 22. 解答题 | 详细信息 |
|
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:O2+4HCl 完成下列填空: (1)该反应化学平衡常数K的表达式为___;实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是___反应(填“吸热”或者“放热”)。 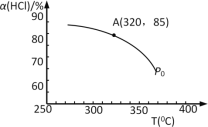 (2)上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线___,并简要说明理由:___。 (3)该反应在P0、320℃条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)=___mol。 (4)对该反应达到平衡后,以下分析正确的是___(选填编号)。 a.增加n(HCl),对正反应的反应速率影响更大 b.体积不变加入稀有气体,对正反应的反应速率影响更大 c.压强不变加入稀有气体,对逆反应的反应速率影响更大 d.如果平衡常数K值增大,对逆反应的速率影响更大 (5)氯元素能形成多种离子。在水溶液中1molCl-、1molClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的化学方程式(用离子符号表示)___;若有1.5molB发生反应,转移电子___mol。 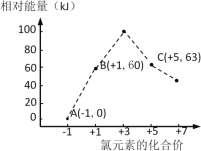 |
|
| 23. 推断题 | 详细信息 |
化合物M是一种医用高分子材料,可用于制造隐形眼镜;以下是M、有机玻璃的原料H及合成橡胶(N)的合成路线。 (1)A中含有的官能团是___(写名称)。 (2)写出反应类型:D→E___;写出反应条件:G→H___。 (3)写出B→C化学反应方程式:___; (4)写出E+F→N化学反应方程式:___。 (5)H在一定条件下能被氧化为不饱和酸 (6)已知:①RCHO ② 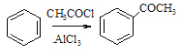 ③ 根据已有知识并结合相关信息,写出以 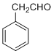 为原料制备 为原料制备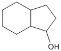 的合成路线流程图(无机试剂任用)___。合成路线流程图示例如下:H2C=CH2 的合成路线流程图(无机试剂任用)___。合成路线流程图示例如下:H2C=CH2 |
|
最近更新



