2019-2020年高二前半期第一次月考化学免费试卷完整版(福建省漳州市平和县第一中学)
| 1. 选择题 | 详细信息 |
|
用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内的物质),不能使溶液恢复到原来的成分和浓度的是( ) A.AgNO3[Ag2O] B.NaOH[H2O] C.KCl[通入HCl气体] D.CuSO4[Cu(OH)2] |
|
| 2. 选择题 | 详细信息 |
|
已知(ⅰ)H2(g)+1/2O2(g)=H2O(g) ΔH=akJ/mol (ⅱ)H2(g)+1/2 O2(g)=H2O(l) ΔH=bkJ/mol (ⅲ)2H2(g)+O2(g)=2H2O(g) ΔH=ckJ/mol (ⅳ)2H2(g)+O2(g)=2H2O(l) ΔH=dkJ/mol 下列关系式中正确的是( ) A.a<b<0 B.c>d>0 C.2a=c<0 D.2b=d>0 |
|
| 3. 选择题 | 详细信息 |
|
下列事实中,与电化学腐蚀无关的是( ) A.远洋海轮的尾部装上一定数量的锌板 B.银纸奖牌久置后表面变暗 C.白铁皮片比马口铁片更耐腐蚀 D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 |
|
| 4. 选择题 | 详细信息 |
|
已知反应:①25℃、101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol; ②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol。 下列结论正确的是( ) A.碳的燃烧热ΔH<-110.5kJ/mol B.反应热有正负之分,标准燃烧热ΔH全部是正值 C.稀硫酸与Ca(OH)2溶液反应的中和热ΔH=-(2×57.3)kJ/mol D.稀醋酸和稀NaOH溶液反应生成1 molH2O,放出57.3kJ的热量 |
|
| 5. 选择题 | 详细信息 |
|
下列过程中,属于放热反应同时又是氧化还原反应的是( ) A.NaOH固体溶于水 B.灼热的炭与CO2反应 C.双氧水催化分解 D.碳酸钙高温分解成氧化钙和二氧化碳 |
|
| 6. 选择题 | 详细信息 |
|
把a、b、c、d四块金属板浸入稀硫酸中,用导线两两相连,可以形成原电池。若a、c相连时,c极溶解;b、d相连时,b极发生氧化反应;a、b相连时,b极流出电子;c、d相连时,c极上产生大量气泡。则四块金属的活动顺序是( ) A.b>d>c>a B.d>c>a>b C.c>a>b>d D.b>c>d>a |
|
| 7. 选择题 | 详细信息 |
|
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。该电池的电解质溶液为KOH溶液,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O A.放电时,正极反应为Cd-2e-+2OH-=Cd(OH)2 B.充电时,阳极区附近溶液的pH不断变小 C.放电时,每转移0.2mol电子,有0.1mol负极材料被还原 D.充电时,阴极反应为2NiOOH-2e-+2OH-=2Ni(OH)2+2H2O |
|
| 8. 选择题 | 详细信息 |
观察下列几个装置示意图,有关叙述不正确的是( )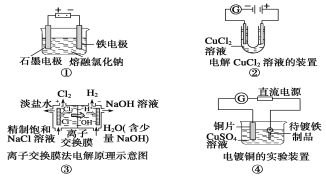 A.装置①工业上可用于生产金属钠,电解过程中石墨电极产生氯气,此法也可用于生产活泼金属镁、铝等 B.装置②中随着电解的进行右边电极会产生红色的铜,并且电流计示数不断变小 C.装置③中的离子交换膜具有很强的选择性,只允许某类离子(如Na+)通过 D.装置④的待镀铁制品应与电源负极相连 |
|
| 9. 选择题 | 详细信息 |
|
用铂(惰性)电极进行电解,下列说法中正确的是( ) A.电解NaOH溶液时,溶液的pH减小 B.电解H2SO4溶液时,在阳极和阴极析出产物的物质的量之比为2∶1 C.电解饱和Na2SO4溶液时,溶液浓度将增大,pH不变 D.电解CuCl2溶液时,溶液浓度将减小 |
|
| 10. 选择题 | 详细信息 |
将如图所示实验装置的K闭合,下列判断不正确的是( )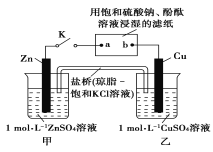 A.Cu电极上发生还原反应 B.片刻后甲池中c(SO42-)不变 C.电子沿Zn→a→b→Cu路径流动 D.片刻后可观察到滤纸a点变红 |
|
| 11. 选择题 | 详细信息 |
如下图所示,下列叙述正确的是( )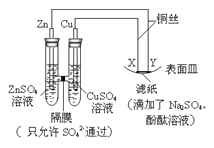 A.Y为阴极,发生还原反应 B.X为正极,发生氧化反应 C.Y与滤纸接触处有氧气生成 D.X与滤纸接触处变红 |
|
| 12. 选择题 | 详细信息 |
|
下列过程都与能量变化有关,其中表述不正确的是( ) A.CO(g)的燃烧热是283.0kJ·mol-1,则表示CO(g)燃烧热的热化学方程式为CO(g)+ B.铝热反应会放出大量的热,因此常温下就能顺利发生 C.拆开化学键需要吸收能量,形成化学键会释放能量 D.化学电池是把化学能转化为电能的装置 |
|
| 13. 选择题 | 详细信息 |
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是 A. 正极电极反应式为:2H++2e—→H2↑ B. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 C. 此过程中铜并不被腐蚀 D. 此过程中电子从Fe移向Cu |
|
| 14. 选择题 | 详细信息 |
|
下列反应中属于吸热反应的是( ) A.CaO+H2O=Ca(OH)2 B.C+H2O=CO+H2 C.HCl+NaOH=NaCl+H2O D.2Al+3H2SO4=Al2(SO4)3+3H2↑ |
|
| 15. 选择题 | 详细信息 |
|
煤是重要的能源和化工原料,直接燃烧既浪费资源又污染环境。最近,某企业利用“煤粉加压气化制备合成气新技术”,让煤变成合成气(一氧化碳及氢气总含量≥90%),把煤“吃干榨尽”。下列有关说法正确的是( ) ①煤粉加压气化制备合成气过程涉及化学变化和物理变化 ②煤粉加压气化制备合成气过程涉及化学变化但没有物理变化 ③该技术实现了煤的清洁利用 ④该技术实现了煤的高效利用 A.①②③ B.①②④ C.①③④ D.②③④ |
|
| 16. 计算题 | 详细信息 |
|
Ⅰ.0.4 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出866kJ的热量。 (1)写出反应的热化学方程式:___; (2)已知H2O(l)转化为H2O(g)的ΔH=+44kJ·mol-1,则22.4L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量是____kJ。 Ⅱ.已知:H2O(g)=H2O(l) ΔH1=-Q1kJ/mol C2H5OH(g)=C2H5OH(l) ΔH2=-Q2kJ/mol C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3kJ/mol 若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为__kJ。 |
|
| 17. 填空题 | 详细信息 |
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: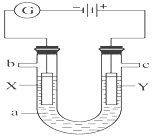 Ⅰ.若X、Y是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞。 (1)写出电解饱和食盐水的离子方程式____; (2)在X极附近观察到的现象是____。 Ⅱ.若用电解方法精炼粗铜,电解液a选用CuSO4溶液,则: (1)X电极电极反应式是____,Y电极的材料是___; (2)当电路中有0.04mol电子通过时,阴极增重___g。 |
|
| 18. 填空题 | 详细信息 |
|
氢氧燃料电池是一种高效低污染的新型电池,主要用于航天领域。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2=2H2O 若酸式电池中的电解质是硫酸溶液,则其正极反应可表示为:____; 若碱式电池中的电解质是KOH溶液,则其负极反应可表示为:____。 |
|
最近更新



